Scoperta e caratterizzazione
Le laccasi sono state per la prima volta isolate nel 1983 dall’albero giapponese della lacca (Rhus vernicifera), da cui il nome. Solo successivamente si sono scoperte laccasi anche in batteri, animali e soprattutto funghi.
Le laccasi sono una classe molto ampia di enzimi ossidasici appartenenti alla della famiglia delle ossidasi blu in grado di ossidare vari composti utilizzando come accettore finale di elettroni l’O2. Nella stessa famiglia di enzimi troviamo anche le ascorbato ossidasi delle piante e la ceruloplasmina nei mammiferi.
Struttura molecolare delle laccasi
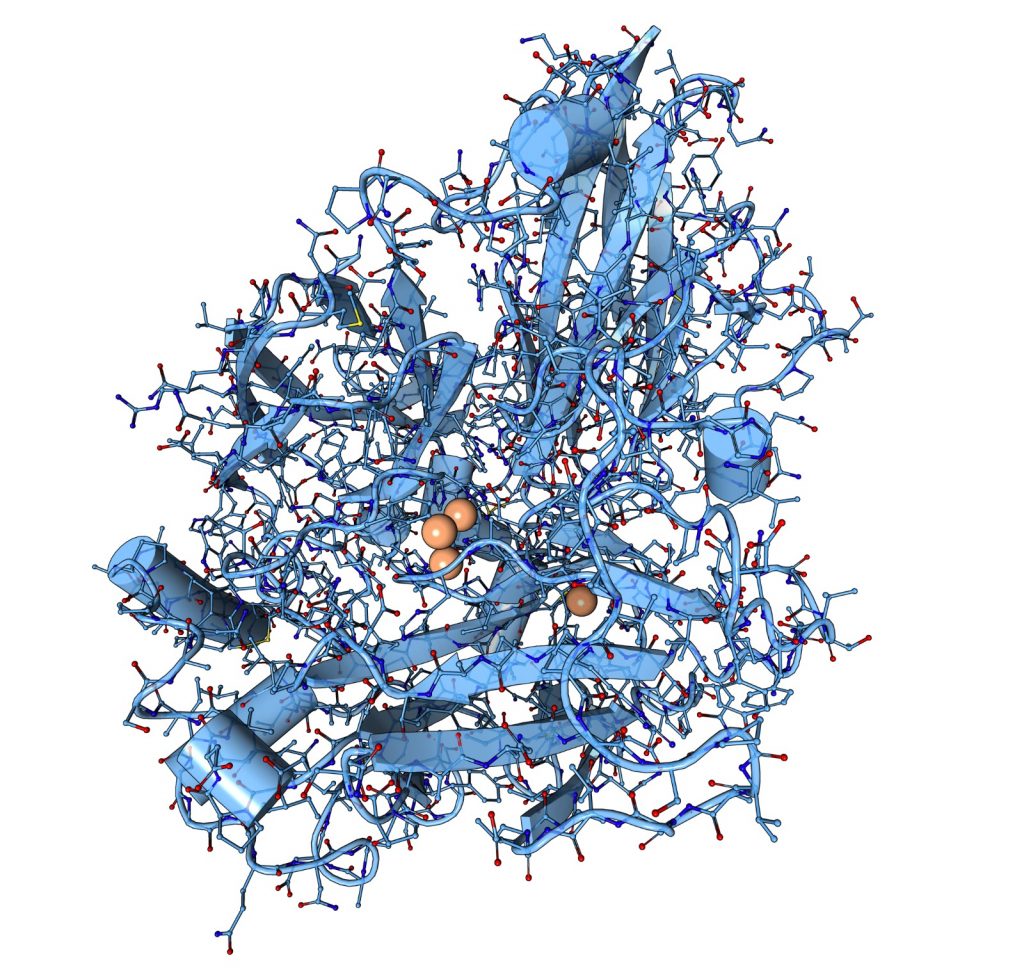
Le laccasi sono strutture semplici caratterizzate da una serie di β-foglietti rivoltati e da 4 siti contenenti Cu (T1, T2, T3, T4). Tutte le ossidasi caratterizzate da più centri rameici sono caratterizzate da un dominio di 10-20 KDa simile alla cupredossina.
In particolare, le laccasi possono essere classificate proprio in funzione del numero di domini simili alla cupredossina. In particolare si distinguono:
- 2dMCOs (Multicopper oxidases) se contengono 2 domini cupredoxin-like;
- 3dMCOs se contengono 3 domini cupredoxin-like;
- 6dMCOs se contengono 6 domini cupredoxin-like.
A livello evolutivo sembra accettata l’ipotesi che le 2dMCOs siano la base da cui si sono originate le 3dMCOs. Questa teoria nasce in virtù del fatto che le laccasi di batteri, piante e animali abbiano 2 domini cupredoxin-like, mentre solo alcuni funghi siano in grado di produrre laccasi a triplice dominio cupredossinico.
Le laccasi dei vari organismi portano organizzazioni strutturali molto differenti tra loro, tuttavia esistono quattro sequenze amminoacidiche molto conservate, nello specifico:
- HXHG (istidina-X-istidina-glicicna);
- HXH (istidina-X-istidina);
- HXXHXH (istidina-X-X-istidina-X-istidina);
- HCHXXXHXXXXMLF (istidina-cisteina-X-X-X-istidina-X-X-X-X-metionina-leucina-fenilalanina).
Il dominio T1 è il sito attivo principale coinvolto direttamente nei processi ossidativi. I centri T2,T3 e T4 sono “sepolti” all’interno della struttura enzimatica e svolgono le funzioni di ricezione degli elettroni sequestrati dal T1.
Spesso le laccasi sono glicosilate, e tra gli zuccheri semplici principalmente associati troviamo esamina, glucosio, fruttosio, galattosio, arabinosio e mannosio.
Funzioni biologiche
L’importanza biologica attribuita alle laccasi è legata all’ampio spettro di substrati ossidabili e la possibiltà di utilizzare O2 come accettore finale. Le funzioni biologiche delle laccasi sono molto variabili a seconda degli organismi in cui si trovano e all’interno del metabolismo in cui si inseriscono.
Molte delle funzioni biologiche delle laccasi, spesso legate all’organismo in cui si trovano, sono strettamente correlate con il potenziale redox del centro T1. Generalmente abbiamo laccasi a basso potenziale redox in batteri, piante e insetti e laccasi da alto potenziale redox nei funghi.
Laccasi batteriche
Tra le laccasi batteriche la più conosciuta è CotA, presente in molti generi di Bacillus. Questo tipo di laccasi, molto termostabile, presenta una cavità che conduce al sito attivo molto più ampia rispetto ad altri enzimi analoghi su altri organismi. La sua attività si esplica principalmente a carico di molecole quali il 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid o ABTS) la siringaldazina (SGZ).
Laccasi vegetali
Nelle piante le laccasi sono state ritrovate sia in gimnosperme che in angiosperme e più recentemente anche nelle alghe verdi. Le laccasi vegetali sono caratterizzate da un basso potenziale redox, circa 430mV.
Le laccasi vegetali sono coinvolte nei processi di:
- Lignificazione;
- Risposte a stress ambientali e di difesa;
- Guarigione delle ferite;
- Metabolismo del ferro;
- Polimerizzazione dei fenoli.
Le laccasi vengono secrete nell’apoplasto, dove catalizzano la sintesi di lignine la rigenerazione dei tessuti danneggiati.
le polifenol ossidasi riscontrate nelle alghe verdi sembrano essere particolarmente importanti nella detossificaizone dei composti fenolici e nella sintesi di pareti cellulari e di composti in grado di assorbire i raggi UV. Un ruolo particolarmente importante viene svolto nell’acquisizione di nutrienti.
Laccasi fungine e patogenicità
A livello generale le laccasi di maggior interesse sono quelle fungine, grazie al loro elevato potenziale redox (circa 800mV). Queste sono coinvolte in moltissime attività, sia nel fungo visto come patogeno che visto come ospite.
Nell’attività patogenica le laccasi assumono un ruolo essenziale nella degradazione di cellulose e soprattutto di lignine. L’elevato potenziale redox rende le laccasi in grado di degradare anche le molecole complesse di lignina senza la necessità di molecole di supporto.
A livello di difesa, invece, questi enzimi sono fondamentali per l’inattivazione e/o la degradazione di una serie di composti molto varia. Nello specifico, sono in grado di ossidare composti non fenolici come ammine aromatiche, carbeni policiclici aromatici, coloranti sintetici e antibiotici come 2,4-diacetilfloroglucinolo o 2,4DAPG. Le laccasi hanno un ruolo come catalizzatore durante la sintesi dell’acido cinnabarinico, un composto antibatterico che può proteggere il fungo da predazione.
Laccasi fungine: altre attività
Altre attività in cui le laccasi vengono coinvolte sono la produzione di melanina per la pigmentazione e tutti i processi che riguardano la costituzione, degradazione, trasformazione e mineralizzazione della sostanza organica.
Il primo gruppo di radicali in genere è prodotto da laccasi fungine a partire da un metossiidrochinone. Questi radicali iniziano una reazione di Fenton fino alla produzione di vari ROS. Un secondo gruppo di radicali si origina dall’ossidazione di molecole naturali, e gli intermedi derivano spesso da substrati già ossidati. L’ossidazione preferenziale della lignina porta al rilascio di residui fenolici con alcuni siti ossidati. Oltre al gruppo idrossile, questi possono contenere anche altri residui funzionali come metossile, ammine, chetoni, aldeidi o carbossili. Tra i decompositori principali troviamo i basidiomiceti; la loro laccasi non decomposne totalmente la lignin,a ma ne modifica integralmente la superficie.
Nel caso della produzione di fenoli dalla lignina, la laccasi rompe i legami tra C1 e C2 conosciuti come Cα-Cβ e anche il legame etra Cα e il gruppo arilico conosciuto come legame alchil-aril.
Laccasi di mammiferi e insetti
Il ruolo principale delle laccasi negli insetti è la sclerotizzazione della cutina nell’epidermide. Questo processo coinvolge l’incorporazione ossidativa di acildopamine come N-acetildopamina (NADA) e N-β-acetildopamina nella matrice della cuticola.
Nell’uomo la laccasi, nonostante abbia un potenziale redox basso, gioca un ruolo importante nella protezione da lignine tossiche derivante da alimenti vegetali.
Variazioni genetiche del codice delle laccasi umane sono associate al rischio del morbo di Crohn, leprossia, ulcere e artriti giovanili.
Via biosintetica delle laccasi
Le laccasi, come tutte le Polifenol-ossidasi, sono enzimi. La loro via biosintetica, come per tutti i protidi, parte dalla sequenza genica che viene trascritta nel nucleo e tradotta nei ribosomi.
L’aspetto particolare di queste proteine è l’aggiunta dei 4 nuclei rameici che avviene all’interno del reticolo endoplasmatico in contemporanea ad altre modificazioni ed elaborazioni della sequenza amminoacidica.
Successivamente l’enzima viene inviato al Golgi per essere poi trasportato nei siti di interesse.
Immagini

Applicazioni biotecnologiche, mediche o industriali delle laccasi
Le applicazioni delle laccasi a livello industriale sono veramente molte. In linea generale il loro impiego ha lo scopo di ridurre l’inquinamento in molti processi in atto, grazie alla loro capacità ossidasica.
Applicazioni industriali
Tra le applicazioni principali vi è quella nell’industria dei rifiuti. Nello specifico, questo enzima viene utilizzato per la degradazione e la detossificazione di molte sostanze pericolose derivanti dall’industria tessile, dall’industria dei coloranti e del cuoio o derivati di prodotti petroliferi.
L’attività degradativa si esplica anche a livello di importanti composti usati in agricoltura come pesticidi e erbicidi. L’applicazione più interessante e attuale è quella nella degradazione del glifosate e dei metaboliti che ne derivano, detti AMPA.
Rimanendo sempre nell’ambito del trattamento dei rifiuti, questi enzimi sono molto efficaci nell’ossidazione di molecole che potrebbero altrimenti essere utilizzate dai microrganismi per il proprio sviluppo, con una conseguente riduzione della quantità di O2 disciolto nell’acqua. Tra tali composti troviamo principalmente carboidrati, acidi nucleici e fenoli.
A livello di sintesi, le laccasi svolgono un ruolo importante nella produzione di biocarburanti, detergenti sintetici e di prodotti antimicrobici.
Applicazioni in biotecnologie mediche
Nelle biotecnologie mediche questi enzimi entrano nel ciclo di produzione di nanoparticelle d’oro che vengono poi opportunamente lavorate per diventare importanti biosensori per l’identificazione di molte malattie in modo poco invasivo.
Un ruolo fondamentale viene svolto anche nell’industria alimentare.
Fonti
- Kunamneni, Adinarayana, Francisco J. Plou, Antonio Ballesteros, e Miguel Alcalde. 2008. «Laccases and their applications: a patent review». Recent patents on biotechnology 2 (1): 10–24.
- Senthivelan, T., J. Kanagaraj, e R. C. Panda. 2016. «Recent trends in fungal laccase for various industrial applications: an eco-friendly approach-a review». Biotechnology and Bioprocess Engineering 21 (1): 19–38.
- Singh, Gursharan, Aditya Bhalla, Paramjit Kaur, Neena Capalash, e Prince Sharma. 2011. «Laccase from prokaryotes: a new source for an old enzyme». Reviews in Environmental Science and Bio/technology 10 (4): 309–26.
Fonti immagini
- Immagine in evidenza e figura 1: Gianluca Tommasello con Protein Imager | 3D Protein Imaging
- Figura 2: AMPA.png (655×536) (wikimedia.org)