Interesse clinico
Cryptococcus neoformans (Fig.1) è un lievito incapsulato che appartiene alla classe Tremellomycetes. Si tratta di un microrganismo aerobio obbligato, capace di sopravvivere all’interno di piante ed animali. Nello stadio teleomorfo si presenta come fungo filamentoso noto generalmente come Filobasidiella neoformans, mentre nello stadio lievitoide può provocare infezioni, anche gravi, in soggetti immunocompromessi o debilitati.
La “criptococcosi” colpisce quindi soggetti fragili, come gli affetti da AIDS, intaccando inizialmente l’area polmonare per poi estendersi al sistema nervoso centrale (meningi) e ad altri organi essenziali.
Gli antigeni solubili di C. neoformans sono rilevabili nel siero, nel Liquido Cefaloarachidiano (CSF), nel Lavaggio Bronco-Alveolare (BAL) e nelle urine. Una diagnosi completa di criptococcosi, infatti, si ottiene combinando l’osservazione al microscopio della forma capsulata, con l’isolamento del microrganismo in coltura e il rilevamento degli antigeni nei liquidi biologici.

Principio del test
Uno dei test diagnostici maggiormente utilizzati in questo contesto è il PastorexTM Crypto Plus (Fig.2), un test qualitativo e semi-quantitativo che permette di rilevare il polisaccaride capsulare di C. neoformans (glucuronossilomannano – GXM) tramite il processo di agglutinazione nei fluidi biologici.
Il test prevede di sfruttare particelle di lattice rivestite da un anticorpo monoclonale anti-GXM della parete capsulare del microrganismo: una reazione tra i due (anticorpo e GMX) si traduce in agglutinazione visibile ad occhio nudo.
Il test può essere applicato a campioni inattivati per 30 minuti a 56°C per evitare contaminazioni da HIV. Tra l’altro, un trattamento enzimatico preventivo (ad eccezione delle urine) può essere necessario per evitare forme di interferenza (aspecifico) e per migliorare la sensibilità del test.
I campioni positivi devono essere successivamente titolati con diluizioni seriali nel tampone. Infatti, il titolo antigenico può fornire indicazioni circa lo stadio e l’entità dell’infezione, inoltre, la determinazione della cinetica antigenica può permettere di valutare l’efficacia della terapia in corso.
Materiale utile
Le confezioni di PastorexTM Crypto Plus per la determinazione antigenica di C. neoformans comprendono:
- Latex Cryptococcus: particelle di lattice sensibilizzate con anticorpi monoclonali anti-glucuronossilomannano (topo), in tampone glicina.
- Controllo positivo antigenico: controllo positivo con polioside capsulare purificato da C. neoformans.
- Tampone diluente: tampone glicina albumina.
- Pronasi: enzima liofilizzato da ricostituire mediante l’aggiunta di 1 ml di acqua distillata.
- Soluzione di arresto: inibitore enzimatico.
- Cartoncini monouso.
- Bastoncini monouso.
Tutti i reagenti contengono sodio mertiolato 0,02% e sodio azide in quantità inferiore allo 0,1%.
Metodo
Come prima cosa è necessario ricostituire l’enzima liofilizzato pronasi con 1 ml di acqua distillata, cercando di evitare la formazione di schiuma. Se i test da svolgere sono di circa 30-40 al mese, è possibile conservare la pronasi ricostituita per quattro settimane a 2-8°C. Al contrario, per serie inferiori, è possibile preparare aliquote da 20 microlitri da conservare a -20°C.
I campioni dovranno essere trattati il più rapidamente possibile dopo il prelievo, ricordando di usare esclusivamente campioni di siero provenienti da provette senza anticoagulanti.
Se il campione non può essere analizzato subito, è possibile (anche se sconsigliabile) conservarlo a 2-8°C per il più breve tempo possibile.
Siero e Lavaggio Broncoalveolare (BAL)
Per preparare il campione al fine di poter svolgere il test, è necessario seguire questi passaggi:
- Porre 120 microlitri di campione in una provetta con tappo ermetico, per poi aggiungere 20 microlitri di pronasi;
- Agitare il tutto e riscaldare a 56°C per 30 minuti;
- Togliere la provetta dal bagnetto termostatato e addizionare una goccia di soluzione di arresto con inibitore enzimatico;
- Omogeneizzare il tutto.
Bisogna fare attenzione che l’acqua del bagnetto di riscaldamento non entri dentro le provette che devono essere munite di chiusura ermetica.
Liquido Cefaloarachidiano (CSF)
Per preparare il campione allo scopo di poter eseguire il saggio, è opportuno seguire questi passaggi:
- Nel caso in cui il CSF fosse evidentemente torbido o contaminato dalla presenza di globuli rossi, si procede con una centrifugazione del liquido per 5 minuti a 350 G (2000 g/min), per poi raccogliere il surnatante;
- Porre 120 microlitri di campione in una provetta con tappo ermetico, poi aggiungere 20 microlitri di pronasi;
- Agitare bene e riscaldare a 56°C per 30 minuti;
- Togliere la provetta dal bagnetto (a 56°C) e bloccare la reazione enzimatica della pronasi tramite riscaldamento a bagnomaria a 100°C per 5 minuti;
- Agitare bene;
- Far raffreddare per 3-4 minuti prima di realizzare l’agglutinazione.
Bisogna fare attenzione che l’acqua del bagnetto di riscaldamento non entri dentro le provette che devono essere munite di chiusura ermetica.
Urine
Per preparare il campione al fine di poter svolgere il test è necessario diluire 1:2 il campione in tampone glicina.
Agglutinazione
Per la reazione di agglutinazione, bisogna seguire questi passaggi:
- Aggiungere 40 microlitri di campione adeguatamente trattato nell’area circolare del cartoncino d’agglutinazione;
- Addizionare 10 microlitri di Cryptococcus latex a lato del cerchio;
- Usare il bastoncino sterile in dotazione per miscelare il tutto;
- Fare un controllo negativo mescolando 40 microlitri di tampone di diluizione con una goccia di lattice;
- Mettere il cartoncino d’agglutinazione in agitazione per 5 minuti (160 giri al minuto) a temperatura ambiente (18-30°C).
Risultati attesi e immagini
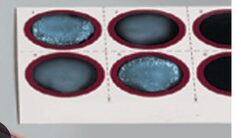
Una reazione positiva al test si esplica con un’agglutinazione delle particelle di lattice con il campione in questione (Fig.3 e Fig.4), e in assenza di agglutinazione con il controllo negativo (lattice e tampone di diluizione). In caso fossero necessarie le titolazioni, lo schema delle diluizioni nel tampone glicina è riportato in Tabella 1:
| Diluizione | 1:10 | 1:100 | 1:1000 | 1:10000 |
| Per campione trattato (μ) | 50 | “ | “ | “ |
| Tampone (μ) | 450 | “ | “ | “ |
Una titolazione precisa viene realizzata mediante diluzioni successive in ragione due a partire dall’ultima provetta positiva. L’interpretazione delle agglutinazioni corrispondenti ad alte diluizioni può variare in funzione di fattori introducibili dall’operatore: si consiglia, quando si eseguono titolazioni di un nuovo campione dello stesso paziente, di confermare il titolo del campione precedente.

Limitazioni del test
L’agglutinazione può essere ostacolata da alte concentrazioni di GXM (fenomeno di prozona). Nel caso in cui il risultato fosse dubbio, è consigliabile rifare il test con una diluizione di 1/100 del campione in questione; in aggiunta a ciò, i risultati andranno interpretati in relazione alla storia clinica del paziente.
Concentrazioni di antigene inferiori alla soglia di rilevamento del test daranno risultati negativi: in tal caso può essere utile ripetere il prelievo successivamente.
La presenza di similitudini antigeniche tra la capsula di Cryptococcus e di Trichosporon beigelii può indurre falsi positivi nei pazienti affetti da tricosporosi.
In aggiunta, come in qualunque tecnica immunologica, non si può escludere l’eventualità di cross-reazioni.
La diagnosi di criptococcosi può essere fatta solo dopo aver confrontato diversi aspetti clinici, radiologici e biologici (microbiologico, istologico e sierologico) dei campioni del paziente.
Ciascun elemento considerato singolarmente va interpretato con estrema cautela.
Controllo qualità
La sensibilità del lattice può essere testata controllando periodicamente con il controllo positivo presente nella confezione, la cui concentrazione in GXM è di 200 ng/ml.
Fonti
- Scheda tecnica Bio-Rad;
- CAMERON M.L, BARTLETT J.A., GALLIS H.A., WASKIN H.A Manifestations of Pulmonary Cryptococcocis in Patients with Acquire Immunodeficiency Syndrome, R.I.D., 1991, 13, p. 64-67;
- STAIB F., Cryptococcocis in Aids – Mycological-diagnostic and epidemiological observations, Aids-Forshung (AIFO), 1987, p. 363-382;
- Cryptococcus neoformans Wikipedia.
Crediti immagini
- Immagine in evidenza: Fine Art America;
- Figura 1: farmacoecura.it;
- 2: diamet.lv;
- 3: fishersci.fi;
- 4: Thermo Fisher Scientific.
Approfondimenti consigliati
Video: Cryptococcus neoformans (And how it affects HIV/AIDS patients)
Lettura: C. neoformans Infection