Lodati come “vaccini di terza generazione”, il DNA e l’RNA messaggero trascritto in vitro (IVT-mRNA) hanno un enorme potenziale per offrire soluzioni pionieristiche per bisogni clinicamente non soddisfatti. Questi vaccini di terza generazione snelliscono le impegnative e dispendiose procedure di produzione utilizzate per i vaccini di prima e seconda generazione. Questi ultimi utilizzano microrganismi e virus inattivati, vivi attenuati o proteine ricombinanti sintetizzate con processi economicamente e temporalmente importanti.
I costrutti vaccinali a base di DNA o IVT-mRNA sono più semplici e sono progettati in modo razionale per istruire le cellule del ricevente a esprimere proteine antigeniche. Queste ultime imitano componenti dei batteri/virus bersaglio al fine di generare immunità umorale e cellulare antigene-specifica per eliminare i veri patogeni contenenti detto antigene quando invadono l’ospite. Poiché le cellule ospiti sono responsabili della produzione dell’antigene, sono garantiti il corretto ripiegamento della proteina e la glicosilazione naturale. Se l’antigene è appropriato, esso induce immunità specifica in seguito alla presentazione da parte delle cellule presentanti l’antigene ai linfociti competenti.
Vaccini a IVT-mRNA per il COVID-19
La gamma di malattie che potrebbero essere affrontate dai vaccini a base di acido nucleico si estende anche al cancro. L’emergere della sindrome respiratoria acuta grave da coronavirus 2 (SARS-CoV-2) ha acceso i riflettori sul campo. I vaccini IVT-mRNA si sono rivelati i ”vincitori” del concorso sanitario pandemico, poiché hanno consentito una velocità inimmaginabile di sviluppo del vaccino oltre a tassi di protezione estremamente elevati contro COVID-19.
Dopo che la sequenza del genoma virale è stata rivelata pubblicamente, ci sono voluti solo 66 giorni per il candidato vaccino 1273-mRNA di Moderna per entrare nella sperimentazione clinica di fase 1. Sia il vaccino 1273-mRNA di Moderna che il vaccino 162b2-mRNA di BioNTech hanno terminato gli studi clinici di fase 3 con un’efficacia del 94-95% nella protezione contro COVID-19 e hanno ottenuto l’autorizzazione all’uso di emergenza entro un anno dallo scoppio della pandemia. BNT162b2 (BioNTech/Pfizer) e mRNA-1273 (Moderna) sono entrambi vaccini IVT-mRNA formulati con nanoparticelle lipidiche e modificati con nucleosidi che hanno ricevuto l’approvazione per l’uso di emergenza dalla FDA (EMA a seguire) con tassi di protezione estremamente elevati contro COVID-19.
Immunità mucosale
Un ostacolo chiave sul percorso di sviluppo di vaccini avanzati riguarda la genesi dell’immunità delle mucose. Molti agenti patogeni, tra cui SARS-CoV-2, infettano l’ospite attraverso la mucosa respiratoria; quindi, l’interazione tra il virus e il sistema immunitario avviene in primis in suddetta mucosa. Il sistema immunitario della mucosa gioca un ruolo chiave nella resistenza dell’ospite all’invasione da agenti patogeni (ergo alla contrazione dell’infezione). La modalità di somministrazione del vaccino potrebbe avere un enorme impatto sull’efficacia dello stesso. E’ dimostrato che questa influisce sull’accessibilità delle cellule immunitarie al priming (fondamentale nella generazione di immunità adattativa) e sulla modalità degli effetti consequenziali (risposte immunitarie sistemiche e/o locali).
Tuttavia, la maggior parte dei vaccini clinicamente disponibili, impiega vie parenterali invasive e genera scarsa immunità mucosale. I vaccini inoculati per via intramuscolare convenzionale inducono esclusivamente una risposta immunitaria sistemica caratterizzata dalla presenza di anticorpi o immunoglobuline G (IgG) sieriche specifiche. La capacità delle IgG sieriche di eliminare i virioni nel sito della mucosa sembrerebbe molto limitata.
È importante sottolineare che il sistema immunitario della mucosa attivato, provoca la produzione di immunoglobulina A secretoria patogeno-specifica (sIgA). Questa tipologia di anticorpo neutralizza efficacemente i patogeni invasori nel muco in una fase iniziale dell’infezione e agisce in prima linea nella difesa contro l’infezione. Inoltre, la somministrazione di vaccini alle superfici mucose può indurre un’immunità sistemica con livelli simili a quella indotta dalla somministrazione parenterale convenzionale. In aggiunta, essendo un approccio di somministrazione intrinsecamente senza ago, la vaccinazione nasale eviterebbe vari problemi associati all’iniezione con ago, come la bassa compliance (collaborazione) e la necessità di personale medico per la somministrazione.
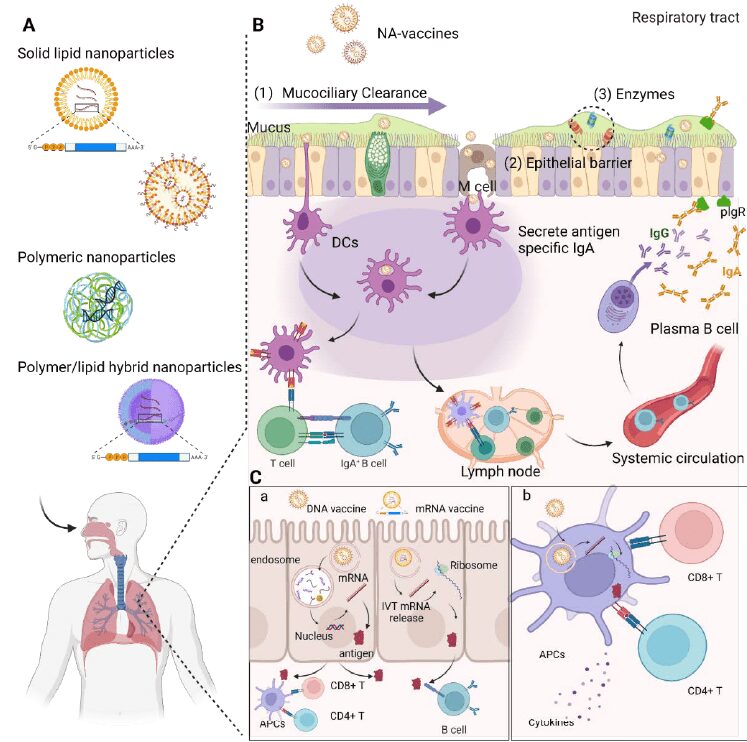
Risposta immunitaria nel tratto respiratorio
Il tratto respiratorio superiore è altamente vascolarizzato ed è la via principale di ingresso dei patogeni inalati. Un tessuto coadiuvante nella risposta immunitaria adattativa mucosale è il tessuto linfoide associato alla mucosa (MALT). Quest’ultimo ha un ruolo importante nella generazione di cellule T helper 1, T helper 2, nonché di cellule B che secernono IgA nei linfonodi.
Le Cellule dendritiche (DC) mucosali catturano gli antigeni dal lato luminale delle vie aeree estendendo i dendriti attraverso le giunzioni strette tra le cellule epiteliali. Altresì le cellule M ( cellule specializzate sovrastanti l’epitelio dei MALT) sono responsabile del trasporto delle nanoparticelle dal lume ai tessuti linfoidi della mucosa sottostanti in un processo chiamato “transcitosi”. Sulla loro superficie basolaterale, le membrane delle cellule M sono profondamente invaginate, formando strutture tascabili in contatto con DC e/o linfociti. Le cellule M sono veicoli cellulari di trasporto dell’antigene perfetti. Oltre al trasporto dell’antigene, le cellule M aiutano anche l’induzione della risposta immunitaria all’antigene trasportato rilasciando un segnale di co-stimolazione per la proliferazione delle cellule T e B.
Risposta immunitaria adattativa mucosale
Successivamente, le Cellule Dendritiche esprimono gli antigeni del vaccino e migrano verso il linfonodo più vicino per attivare i linfociti T e B. I linfociti B attivati proliferano nel linfonodo ed entrano nella circolazione sistemica nei siti effettori della mucosa. Le cellule B si differenziano localmente in plasmacellule che secernono dimeri di IgA. Inoltre anche IgG sistemiche antigene-specifiche verranno prodotte.
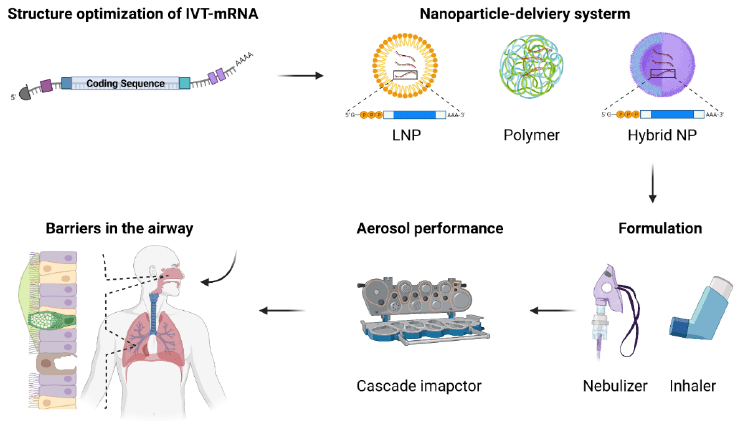
Sistemi di delivery dei vaccini nasali
Una importante barriera tecnica nel processo di traduzione clinica delle terapie IVT-mRNA è lo sviluppo di sistemi di delivery sicuri ed efficienti. La possibilità di stabilire una potente immunità protettiva con un vaccino IVT-mRNA è in gran parte attribuita alla scelta di un sistema di somministrazione sicuro ed efficiente. Il successo della consegna a bassi dosaggi di IVT-mRNA ai polmoni aprirebbe un campo significativo per terapie o vaccini progettati per l’applicazione polmonare. Questo sforzo, tuttavia, rimane difficile poiché la funzione dell’IVT-mRNA e la struttura delle nanoparticelle possono essere significativamente compromesse dal processo di nebulizzazione.
Oltre a ciò, gli aspetti biologici delle vie aeree pongono altre barriere contro la somministrazione nebulizzata di IVT-mRNA. Le cellule, le proteine, le biomolecole e le barriere fisiche con cui le nanoparticelle interagiscono quando vengono erogate tramite nebulizzazione differiscono da quelle con cui interagiscono nel flusso sanguigno. Tuttavia, ci sono già stati diversi report sulla consegna efficiente di IVT-mRNA alle vie aeree. Le nanoparticelle di delivery utilizzati in questi report sono state: Nanoparticelle lipidiche (LNP), PEI (polietereimmide) o nanoparticelle ibride (lipidiche-polimeriche).
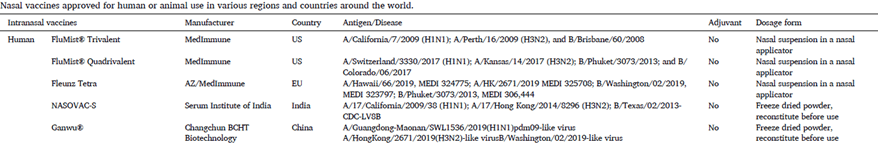
Traslazione clinica dei vaccini nasali
FluMist® Quadrivalent,è un vaccino antinfluenzale vivo attenuato tetravalente prodotto da MedImmune, e viene somministrato come spray intranasale. FluMist®, originariamente approvato nel 2003 (FDA) con formulazione trivalente, è stato approvato come FluMist® Quadrivalente nel 2012 per comprendere quattro ceppi di virus dell’influenza. Fluenz Tetra è una versione europea approvata nel 2013 di FluMist. Anch’essa è una sospensione spray nasale di vaccino antinfluenzale contenente quattro diversi ceppi di virus influenzali vivi attenuati. Nasovac-S, un vaccino intranasale vivo attenuato prodotto dal Serum Institute of India, conferisce protezione contro l’influenza pandemica H1N1. Ganwu® (Vaccino influenzale, vivo, nasale, liofilizzato), invece è un vaccino antinfluenzale vivo attenuato tetravalente approvato in Cina nel 2020.
I vaccini intranasali sono usati più frequentemente negli animali che negli esseri umani. I vaccini intranasali approvati per uso animale negli Stati Uniti si sono dimostrati incredibilmente efficaci per numerose infezioni. Tra queste troviamo vaccini per:
- l’herpesvirus di tipo 1 (BHV-1),la parainfluenza 3 (PI3),il virus respiratorio sinciziale (BRSV), e la rinotracheite (IBR) nei bovini,
- Virus dell’influenza H3N8 nei cavalli,
- Bordetella bronchiseptica, parainfluenza e adenovirus nei cani,
- Coronavirus causante Peritonite infettiva nei gatti,
- virus dell’influenza A e B.bronchiseptica nei suini.
Fonti
Immagini
- https://jamanetwork.com/journals/jama/fullarticle/2785303?guestAccessKey=5c9e5d61-b3d8-43ce-bbde-ff9a6e46d6c8&utm_source=silverchair&utm_medium=email&utm_campaign=article_alert-jama&utm_content=olf&utm_term=101421(Figura1)
- https://pubmed.ncbi.nlm.nih.gov/35055244/ (Figura 2-3)
- https://pubmed.ncbi.nlm.nih.gov/34637935/ (Figura 4)