Il sistematico ed indiscriminato sfruttamento delle risorse di questo pianeta ha portato negli ultimi anni problemi enormi di natura ambientale. Per questo motivo lo sviluppo di tecnologie e biotecnologie chimiche pulite, ed al contempo economicamente sostenibili, riveste oggi un grande interesse.
Il settore agricolo è stato additato come uno dei principali responsabili dell’inquinamento del nostro pianeta e lo stesso si può dire dei settori che si occupano di sintesi organica. Da qui nasce l’esigenza dello sviluppo di un’industria più ecocompatibile che negli ultimi anni dalle biotecnologie ha ricevuto una risposta concreta: la sostituzione di processi chimici altamente inquinanti con alternative “biotecnologiche”, quali per esempio le reazioni enzimatiche. L’importanza pratica degli enzimi, sia in sostituzione dei catalizzatori tradizionali nei processi industriali, sia come componenti di prodotti finali, è destinata a crescere con la presa di coscienza che essi sono praticamente privi di effetti dannosi sull’ambiente. Le industrie tendono infatti ad applicare sempre più processi meno pericolosi o dannosi per l’ambiente, nonché a rispondere all’esigenza di attuare procedimenti industriali a ridotto impatto ambientale. Un esempio di organismi che producono enzimi industrialmente interessanti è costituito dai funghi basidiomiceti white-rot.
Questi producono una famiglia di enzimi tra i quali la laccasi (fig.1) che è in grado di operare interessanti trasformazioni. D’altra parte l’univoca corrispondenza tra la possibilità teorica e lo sfruttamento pratico di molti processi enzimatici è arginata soprattutto dai problemi economici correlati al costo di produzione degli enzimi e dalla possibilità di riutilizzo e conservazione degli stessi. Tuttavia, la resistenza alla denaturazione e l’efficienza catalitica degli enzimi può essere incrementata confinandoli entro un sistema che in qualche modo li protegga dagli agenti esterni e li renda facilmente separabili, recuperabili e riutilizzabili. L’isolamento o l’immobilizzazione degli enzimi per scopi biotecnologici è una tematica sviluppata da alcuni anni da molti gruppi di ricerca e comprende ormai numerose tecniche che sono state applicate a diverse proteine e a svariati supporti organici o inorganici.
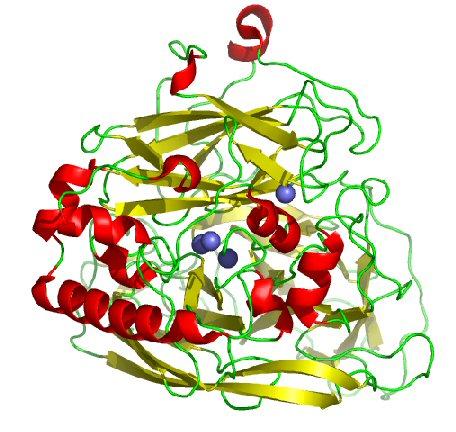
Le proteine vengono impiegate in svariati settori, quali le industrie farmaceutiche, biomediche, dei reagenti analitici, chimiche e manifatturiere.
Alcune di queste proteine possono essere estratte facilmente, a volte con costi elevati, partendo da materiale facilmente disponibile, come ad esempio colture microbiche o piante; più spesso la fonte della proteina è difficile da ottenere o è caratterizzata da una bassa produzione. Per risolvere questo problema e soddisfare questa grande richiesta, si utilizzano tecniche di DNA ricombinante al fine di ottenere una produzione elevata, efficiente e controllata.
L’espressione di geni in sistemi eterologhi nasce dalla difficoltà di esprimere geni, di qualunque natura, in organismi superiori assai complessi e soggetti a regolazioni non sempre pienamente comprese. Per adoperare questa tecnica bisogna valutare diverse variabili, quali la scelta dell’ospite e del vettore. Si procede isolando il gene che codifica per la proteina d’interesse e la si inserisce in un vettore d’espressione capace di replicarsi ed essere espresso in un certo ospite.
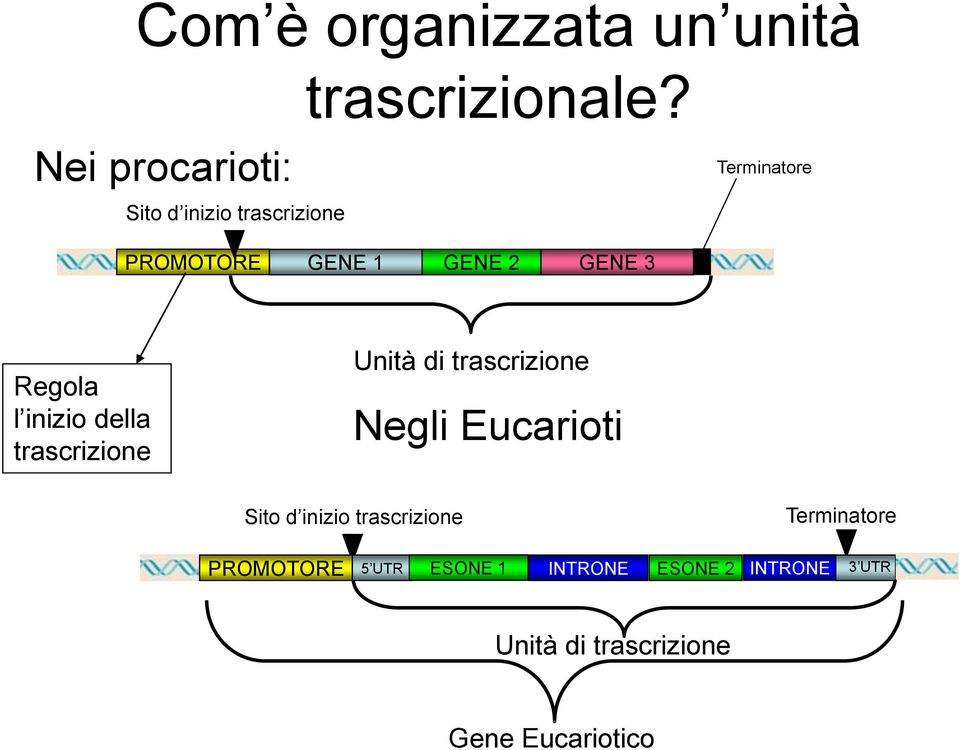
A monte del sito di clonaggio del gene, deve esserci un promotore (che può essere costitutivo o inducibile), e se si vuole ottenere la secrezione del prodotto, dopo il promotore si inserisce una sequenza segnale che indirizzi la proteina nell’apparato secretorio; ed infine deve essere presente un terminatore della trascrizione a valle del gene (fig.2). Terminatore e promotore devono essere riconosciuti dall’organismo ospite. La produzione di grosse quantità della proteina d’interesse (non utile alla cellula) porterà inevitabilmente ad una riduzione nella velocità di crescita, in quanto la cellula utilizzerà risorse per fini diversi dalla soddisfazione del proprio fabbisogno. La diminuzione della velocità di crescita causerà di conseguenza una riduzione dell’efficienza del processo. Se la proteina è per di più dannosa, il problema sarà maggiore. Una ridotta crescita delle cellule trasformate porta ad una pressione selettiva in favore di un potenziale mutante non produttivo. Per risolvere questo problema si possono utilizzare promotori inducibili, in modo che alterando le condizioni di coltura si vada ad indurre la produzione della proteina d’interesse.
Il lievito (fig.3) è un organismo eucariotico unicellulare, appartenente al Regno Fungi. Le cellule di lievito possono avere forma ellittica o sferica ed hanno dimensione variabile da pochi mm a 20-30 mm. La struttura interna è quella eucariotica e presentano una parete cellulare che ricopre la membrana citoplasmatica. I lieviti sono tipicamente aerobi facoltativi e crescono sia in modo aerobio sia per fermentazione. Si può sfruttare questa caratteristica per indurre la produzione e l’accumulo della proteina d’interesse intervenendo dall’esterno sulla regolazione del metabolismo, andando a cambiare le condizioni colturali.
Attualmente il sistema maggiormente utilizzato è Escherichia coli, in quanto si ha una profonda conoscenza del metabolismo e fisiologia di questo microrganismo; l’ingegneria genetica è nata proprio grazie ad esperimenti fatti su questo microrganismo.
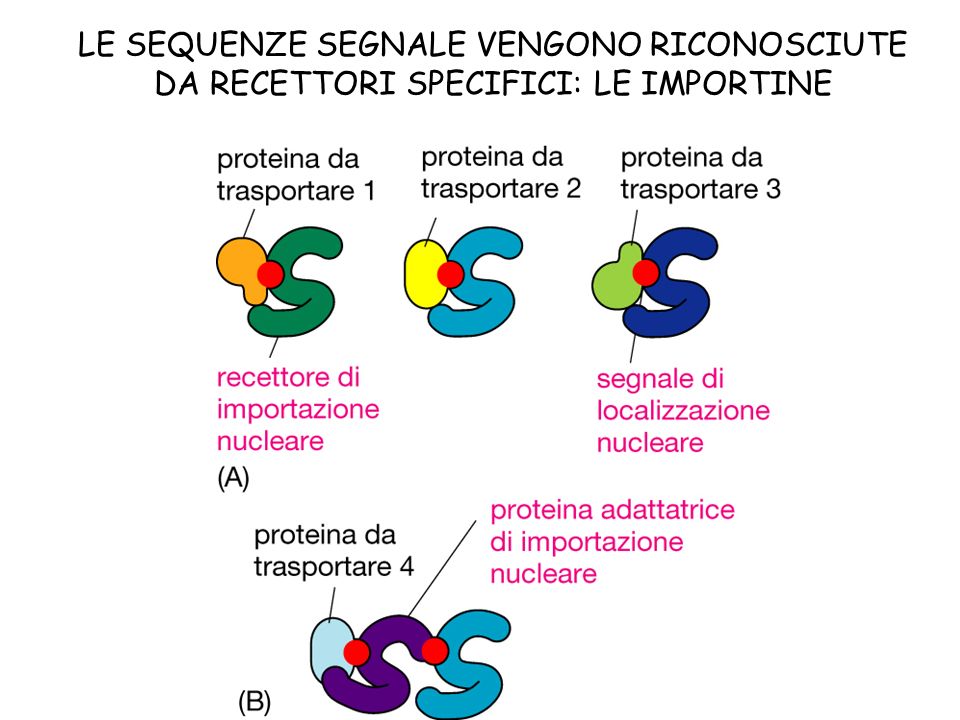
Bisogna valutare la quantità di proteasi presenti nell’ospite; le proteasi sono enzimi essenziali per la vitalità della cellula, ma se presenti in abbondanza potrebbero portare ad una diminuzione dell’efficienza di produzione di proteine eterologhe. La stabilità della proteina potrebbe aumentare se secreta nel mezzo, a meno che l’organismo utilizzato non secerna proteasi. La localizzazione della proteina può influenzare i livelli di prodotto ottenuti. Se la proteina rimane nel citoplasma, a concentrazione elevate potrebbe diventare insolubile, portando alla formazione di corpi di inclusione. È generalmente vantaggioso ottenere la secrezione della proteina, attaccando a questa una sequenza segnale (fig.4).
Per la maggior parte delle proteine le fonti di produzione naturale non sono sufficienti a produrre quantità adeguate. L’over-espressione ricombinante di proteine è un metodo universalmente adottato per ottenere quantità elevate, che vanno dal milligrammo al grammo, necessarie per le più diverse applicazioni quali la genomica strutturale o la produzione biofarmaceutica. La tecnica standard prevede la produzione di elevate quantità di proteine ricombinanti e la successiva purificazione; essa comporta la clonazione di un gene appropriato in un vettore sotto il controllo di un inducibile promotore. Tuttavia la produzione efficiente di un gene ricombinante dipende da una varietà di fattori quali le proprietà strutturali della sequenza del gene, la stabilità ed efficienta del mRNA, il corretto ed efficiente ripiegamento della proteina, uso dei codoni, degradazione della proteina ricombinante dovuta alle proteasi dipendenti dall’ATP, di tossicità caratteristiche della crescita cellulare.
Nonostante la grande quantità di conoscenze maturate nell’ambito dell’ingegneria della cellula, finora è stata posta poca attenzione agli effetti della composizione del mezzo sulla produzione delle proteine ricombinanti. Per massimizzare la produttività volumetrica della proteina ricombinante è necessario raggiungere un punto di equilibrio che rappresenti il miglior compromesso fra il bilanciamento dei livelli di espressione del gene e della crescita cellulare.
Luana Bignozzi
Fonti:
- https://www.unifi.it/upload/sub/assegni/2011/cerm_dd26_200111_progr1.pdf
- http://dspace.unitus.it/bitstream/2067/1238/1/fsilvestri_tesid.pdf