La biomimetica è definibile come un approccio progettuale basato sulla teoria e sulla tecnologia di un sistema biologico, al fine di risolvere necessità tecniche. Questo termine venne coniato nel 1957 da Otto Schmitt per descrivere gli aspetti interdisciplinari che mettono in relazione biologia e fisica per utilizzare i principi di base di ciascuno per affrontare un problema riscontrato da entrambi.
Nella somministrazione di farmaci, le strategie biomimetiche mirano a riutilizzare il percorso di attività delle strutture biologiche negli organismi viventi per ottenere numerosi vantaggi tra cui la biocompatibilità e la capacità di biodegradabilità. L’imitazione delle vie del segnale e di comunicazione cellulare è un’altra strategia biomimetica esplorata per lo sviluppo di sistemi di nanodelivery. In riconoscimento del potenziale dei principi biomimetici, le strategie di progettazione biomimetica vengono combinate con la nanotecnologia per potenziare i vantaggi dei nanosistemi antibatterici per renderli più biocompatibili, fornire proprietà di targeting avanzate, causare meno immunogenicità, minore tossicità e migliorare la biodegradabilità e il tempo di circolazione.
Nanosistemi antibettirici biomimetici
L’applicazione di strategie biomimetiche ha portato alla costruzione di nanosistemi biomimetici con profili di biosicurezza avanzati e proprietà mirate, con effetti di neutralizzazione delle tossine, una migliore efficacia antibiotica e una maggiore interiorizzazione nelle cellule batteriche. Inoltre, questi nanosistemi hanno la capacità di prevenire l’adesione batterica, la colonizzazione e le infezioni associate all’inserimento chirurgico di impianti biomedici.
La crescente crisi di resistenza ai farmaci e agli antibiotici evidenzia la necessità di combinare approcci biomimetici con la nanotecnologia per ottenere un trattamento ottimale delle infezioni batteriche.
Le diverse strategie biomimetiche per migliorare la sintesi e la consegna di nanosistemi antibatterici includono la sintesi biomimetica di nanoparticelle antibatteriche e le strutture mimetiche cellulari, extracellulari e di superfici biologiche.
Strategie biomimetiche per il miglioramento della sintesi di nanoparticelle antibatteriche
L’imitazione dei percorsi di sintesi biologica nella sintesi di nanoparticelle di metallo e ossido di metallo è un metodo ben noto ed efficace, che mira a produrre nanoparticelle all’interno di un intervallo di dimensioni efficace. Inoltre essa è finalizzata a raggiungere proprietà antibatteriche con citotossicità minima, in condizioni economiche ed ecocompatibili. La sintesi biomimetica comporta l’imitazione in vitro di uno o più processi biologici, che includono unità elementari, biologiche e processi vitali superiori. La sintesi biomimetica elementare tramite modello di biomassa è la strategia più comunemente applicata, che utilizza estratti vegetali e altri modelli di biomassa. I metodi biomimetici presentano vantaggi significativi rispetto ad altri metodi di sintesi fisica e chimica convenzionali di nanoparticelle di metallo e ossido di metallo. Oltre ai vantaggi menzionati in precedenza, la sintesi biomimetica può ottenere risultati aggiuntivi come stabilità, biocompatibilità e attività antibatterica sinergica.
Nel corso degli anni, la sintesi di nanoparticelle di metallo e ossido di metallo tramite approcci biomimetici si è concentrata principalmente sulla sintesi di nanoparticelle d’argento (AgNPs). Questo focus è dovuto al fatto che gli AgNP presentano ampio spettro di attività antibatterica contro batteri patogeni multiresistenti (MDR), attraverso molteplici meccanismi d’azione, come l’adesione della membrana batterica, la capacità di penetrazione cellulare e l’arresto delle attività cellulari vitali, nonché l’induzione di stress ossidativo che disgrega le strutture cellulari.
Strategie biomimetiche per migliorare il rilascio di nanoparticelle antibatteriche
- Mimetismo superficiale: l’imitazione delle strutture cellulari è utilizzata per migliorare i parametri farmacocinetici delle nanoterapie antibatteriche come strategia biomimetica. In questo campo vengono applicati due approcci: (1) Rivestimento di nanoparticelle con membrane cellulari estratte, per imitare la superficie esterna della cellula per migliorare la biocompatibilità e il tempo di circolazione dei nanocarrier convenzionali; (2) Nanocapsule lipidiche biomimetiche (LNC) che imitano le strutture cellulari, in particolare la membrana lipidica esterna delle cellule.
Il biomimetismo delle strutture cellulari è finalizzato alla neutralizzazione di tossine batteriche e distruzione di biofilm. L’imitazione di substrati naturali di tossine batteriche, come i globuli rossi, viene stabilita attraverso il rivestimento di nanoparticelle polimeriche con membrane cellulari estratte da Eritrociti. Queste nanoparticelle rivestite (indicate come nanospugne) servono come bersagli di danno per alcune tossine batteriche e, pertanto, possono rendere innocue tali tossine e inibirne le azioni dannose. Tale meccanismo prevede perciò un sequestro delle tossine batteriche che hanno gli eritrociti come target, evitando così che leghino massivamente gli eritrociti endogeni. Questo approccio biomimetico è introdotto come strategia innovativa per trattare le infezioni batteriche e ridurre l’effetto delle malattie associate.
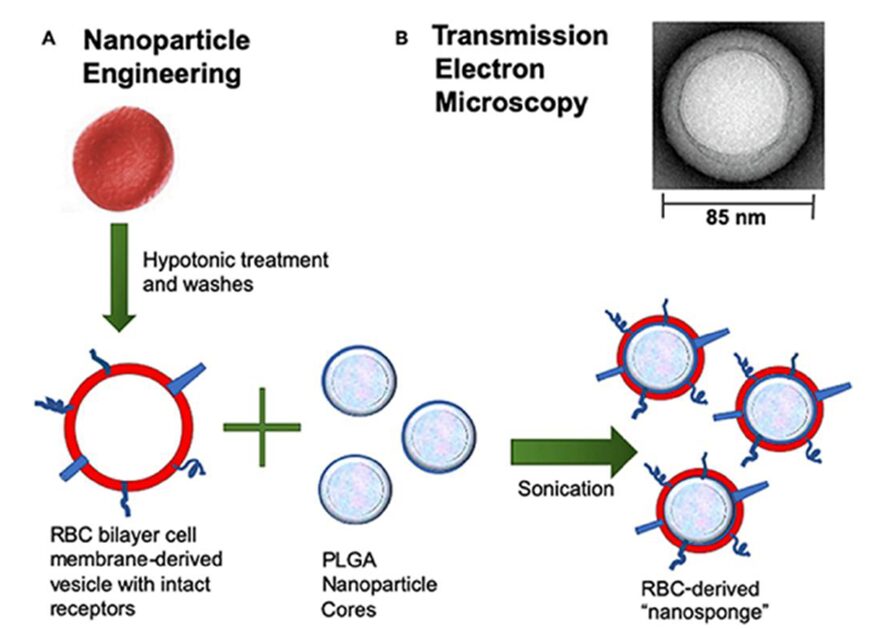
- Mimetismo extracellulare (Matrice): questo mimetismo è finalizzato al miglioramento di parametri di farmacocinetica. Grazie a tale approccio, i parametri farmacocinetici dei nanosistemi antibatterici sono notevolmente migliorati. Essi vengono incorporporati con materiali che imitano le proprietà biologiche e fisico-chimiche della matrice extracellulare. Questi materiali sono progettati per scopi di ingegneria ossea e tissutale per fornire un microambiente ottimale per la crescita cellulare. L’incorporazione di proprietà antibatteriche è introdotta per prevenire e trattare l’infezione batterica associata all’impianto chirurgico di questi materiali. Questa sezione discute tale incorporazione come strategia biomimetica per migliorare parametri di farmacocinetica dei nanosistemi antibatterici. Perciò possiamo considerare i materiali che imitano le strutture extracellulari (come ad esempio scaffold di nanocristalli di idrossiapatite) come vettori di consegna di agenti antibatterici. Tra i vari sistemi di drug delivery antibatterico che utilizzano tale biomimetismo, spiccano:
– Nanocristalli di idrossiapatite come vettori di rilascio biomimetico per agenti antibatterici
– Scaffold (ossei o preposti al wound healing) come nanocarrier di rilascio biomimetico per agenti antibatterici

- Mimetismo delle superfici biologiche: approccio finalizzato a prevenire l’adesione batterica e la formazione di biofilm sulle superfici degli impianti biomedici. L’adesione batterica e la formazione di biofilm sulla superficie degli impianti biomedici sono essenziali per lo sviluppo di infezioni batteriche associate al loro inserimento chirurgico. Per prevenire e trattare queste infezioni sono state impiegate diverse strategie, tra cui la modifica della superficie, il rivestimento antibatterico e l’interruzione del biofilm. La modifica della superficie mediante l’imitazione delle superfici biologiche combinata con agenti antibatterici incorporati all’interno è la strategia più efficiente per combattere le infezioni batteriche associate alla chirurgia implantare biomedica. L’imitazione delle superfici biologiche offre una buona inibizione dell’adesione batterica e della formazione di biofilm, mentre gli agenti antibatterici possono sradicare e uccidere i batteri attorno a questi impianti. Diversi studi hanno riportato la co-deposizione di AgNPs/HA per aggiungere attività antibatterica per prevenire le infezioni batteriche.

In conclusione, nonostante i vantaggi e le superiorità evidenziati in questa recensione, i nanosistemi antibatterici biomimetici sono lontani dalle fasi di approvazione normativa. Ciò è causato dalla necessità di ulteriori studi per valutare la loro stabilità a lungo termine, le interazioni con altri processi biologici e la fattibilità di tecniche di produzione e caratterizzazione su larga scala.
Fonti:
- https://pubmed.ncbi.nlm.nih.gov/33486023/
- https://biomimicry.org/combating-bacteria-on-hospital-surfaces-natures-way/
Immagini:
- https://plastics-themag.com/Better-understanding-molecular-interactions-is-crucial-to-biomimicry-
- https://biomimicry.org/combating-bacteria-on-hospital-surfaces-natures-way/
- https://www.researchgate.net/figure/mages-of-macroporous-scaffolds-obtained-from-biomimetic-hydroxyapatite-a-An-injectable_fig3_337369575