I batteri gram-negativi, oltre a possedere una membrana citoplasmatica e uno strato di peptidoglicano, sono caratterizzati dalla presenza di una membrana esterna legata in modo covalente ai tetrapeptidi del peptidoglicano mediante una lipoproteina. Lo strato più esterno di questa è costituito dal lipopolisaccaride (LPS). Questi elementi sono tossici in molte circostanze, ed indicate anche con il termine di endotossine, poiché parte integranti della cellula.
Lipopolisaccaride (LPS), elemento centrale delle endotossine batteriche
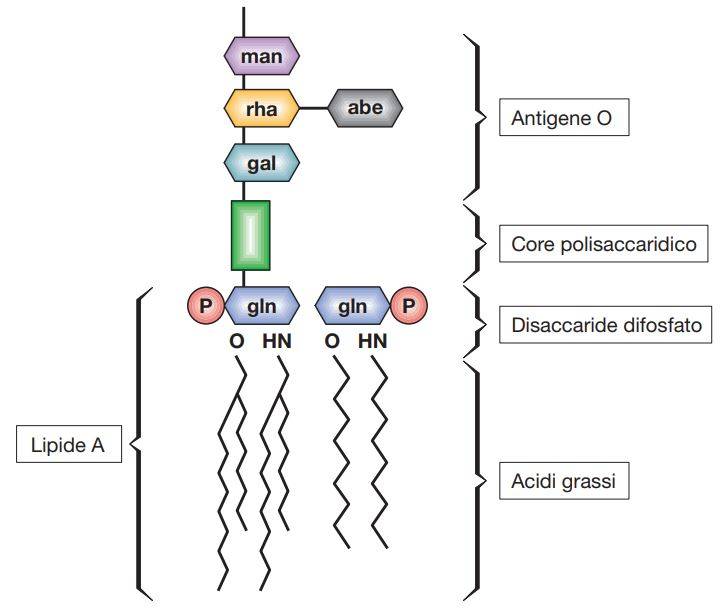
Studi su animali di laboratorio hanno dimostrato che, per avere un effetto tossico tipico delle endotossine batteriche, in vivo, sono richieste sia la componente lipidica sia parte di quella polisaccaridica dell’LPS, che rende il complesso idrosolubile e immunogenico. Per quanto complessa, la struttura chimica di alcuni LPS è ben conosciuta, in particolare quella delle Enterobacteriaceae (E. coli, Shigella e Salmonella): la porzione polisaccaridica dell’LPS consiste di due frazioni, il polisaccaride interno o core polisaccaridico (costituito da inner core e outer core) e il polisaccaride esterno, chiamato anche polisaccaride O (antigene O).
In Salmonella, dove è stato ben caratterizzato, il core polisaccaridico è costituito da chetodeossiottonato (KDO), zuccheri a sette atomi di carbonio, glucosio, galattosio e NAG (N-acetilglucosamina). Strettamente connesso al core è l’antigene O, che contiene galattosio, glucosio, ramnosio e mannosio (tutti zuccheri a sei atomi di carbonio), oltre a uno o più dideossizuccheri, quali abequosio, colitosio, paratosio o tivelosio. La porzione lipidica dell’LPS, detta lipide A, è costituita da acidi grassi (caproico, laurico, miristico, palmitico, stearico), legati tramite un legame estere-aminico a un disaccaride costituito da N-acetilglucosamina fosfato, con legame α (1-6).
Il lipide A è parte integrale della membrana esterna, dove sostituisce i fosfolipidi, ed è attaccato al core polisaccaridico tramite il KDO. Il lipide A, verosimilmente, possiede la maggior parte delle più importanti proprietà biologiche associate al lipopolisaccaride e sembra essere direttamente coinvolto nella genesi della sintomatologia delle malattie da batteri gram-negativi (Salmonella, Shigella, Escherichia, ecc.), come la febbre, la proteolisi muscolare, la coagulazione intravascolare disseminata e lo shock. La tossicità del lipide A risiede principalmente nella sua capacità di attivare il complemento e di stimolare il rilascio di citochine (IL-1, IL-6, IL-8 e ΤΝF-α) da parte di monociti, macrofagi e altre cellule con funzioni biologiche normalmente coinvolte nella difesa dell’ospite contro i microrganismi invasori.
LPS binding protein (LBP), altro elemento centrale delle endotossine
È stato dimostrato, in diversi studi sulle basi molecolari dello shock settico, che l’LPS rilasciato in seguito alla lisi dei batteri gram-negativi è in grado di legare una glicoproteina plasmatica, chiamata LPS binding protein (LBP), essenziale per la rapida induzione della risposta infiammatoria. Il complesso LPS-LBP interagisce, a sua volta, con il recettore CD14 presente su monociti, macrofagi, cellule endoteliali e altre cellule ospiti. CD14 è una glicoproteina ancorata alla membrana cellulare attraverso il glicosilfosfatidilinositolo (GPI). I recettori CD14 espressi in membrana (mCD14) sono organizzati in microdomini chiamati lipid raft, e coinvolti in numerosi processi cellulari tra cui la transcitosi, la podocitosi e la trasduzione del segnale. CD14 esiste anche sotto forma di molecola solubile (sCD14), che sembra avere un ruolo importante nell’attivazione, mediata dall’LPS, di cellule CD14 negative come le cellule epiteliali e le cellule muscolari lisce.
Il recettore CD14, molecola coinvolta nella risposta immunitaria innata, risulta implicata nell’attivazione dei monociti, nell’interazione dei leucociti con le cellule endoteliali, nella regolazione della morte cellulare programmata o apoptosi nei monociti e nelle cellule endoteliali, e nello sviluppo di alterazioni vascolari come l’aterosclerosi e la coagulazione intravascolare disseminata.

TLR
Per l’attivazione dei pathway intracellulari di trasmissione del segnale è necessaria l’interazione di CD14 con un corecettore, tra cui il più importante è il TLR4 (Toll-like receptor 4), e con proteine accessorie, come MD-2 (anche nota come Ly96). I TLR sono membri della famiglia di recettori per IL-1 (IL-1R), un sistema di trasduzione del segnale attraverso l’attivazione delle MAPΚ, conservato nell’evoluzione, che svolge un ruolo critico nella risposta immunitaria innata e nella risposta infiammatoria contro i microrganismi patogeni. L’LPS mostra un’ampia variabilità tra i diversi ceppi batterici, e per garantire una risposta ad ampio spettro contro i gram-negativi, i recettori dell’LPS sono diretti essenzialmente verso il lipide A, la frazione conservata della molecola, che è anche il frammento minimo necessario per innescare la risposta cellulare.
Tuttavia, come accennato in precedenza, la variabilità del core e dell’antigene O possono significativamente influenzare la risposta e il tipo di pathway di trasduzione del segnale. Nella continua lotta tra batteri e sistema immunitario, i patogeni hanno evoluto la capacità di modificare alcune caratteristiche conservate dei pattern molecolari associati ai patogeni (PAMP). Delle modificazioni a carico dell’LPS va segnalata la coniugazione del gruppo fosfato del lipide A, che riduce la sensibilità verso i peptidi antimicrobici cationici e altera il riconoscimento da parte dei recettori LBP/CD14/ MD-2.
Un’altra modificazione è la variabilità in lunghezza, numero e disposizione delle catene aciliche, che cambia a seconda delle condizioni di crescita e della specie batterica. In particolare, tale fenomeno è stato ben studiato in Yersinia, che passa da una forma prevalentemente esa-acilata del lipide A, osservata a basse temperature negli insetti ospite, a una forma tetra-acilata del lipide A, alla temperatura degli animali a sangue caldo come ospiti alternativi. Questo permette ai batteri di eludere il riconoscimento da parte del sistema immunitario innato, in particolare il riconoscimento da parte del complesso TLR4/MD-2.
Secondo i dati più recenti relativi al riconoscimento dell’LPS, evento che richiede tre differenti recettori extracellulari consecutivi, si ritiene che la LBP si leghi agli aggregati di LPS; successivamente l’LPS in forma monomerica viene trasferito al CD14, che è richiesto a sua volta per trasferire in modo efficiente il monomero di LPS a MD-2, che si trova sia in forma solubile che associata al TLR4. In realtà, CD14 non funge semplicemente da spola della forma monomerica dell’LPS ma è essenziale anche per la scelta del pathway di trasduzione del segnale.
La formazione di un complesso trimerico LPS:MD-2:TLR4 è l’evento finale del riconoscimento extracellulare dell’LPS. Infine, riarrangiamenti del complesso MD-2/TLR4 permettono il reclutamento di proteine di adattamento per i domini intracellulari (TIR) del TLR4, innescando la cascata di segnali che porta all’attivazione di geni attraverso la traslocazione di fattori trascrizionali nel nucleo. In particolare questo segnale porta all’attivazione di NF-κB (fattore nucleare κB) e di altri pathway di citochine: NF-κB migra verso il nucleo cellulare e inizia la trascrizione dei geni codificanti per diversi a mediatori dell’infiammazione.
Fonti
- Didelot, X. et al. (2016), «Within-host evolution of bacterial pathogens», Nat Rev Microbiol, 14(3), pp. 150-62.
- Fleischmann, R.D. et al. (1995), «Whole-genome random sequencing and assembly of Haemophilus influenzae Rd», Science, 269(5223), pp. 496-512.
- Goodwin, S. et al. (2016), «Coming of age: ten years of next-generation sequencing technologies», Nat Rev Genet, 17(6), pp. 333-351.
- Johnson, C.M. et al. (2015), «Integrative and Conjugative Elements (ICEs): what they do and how they work», Annu Rev Genet, 49, pp. 577-601.
- Margulies, M. et al. (2005), «Genome sequencing in microfabricated high-density picolitre reactors», Nature, 437(7057), pp. 376-380.
- Ronaghi, M. et al. (1996), «Real-time DNA sequencing using detection of pyrophosphate release», Anal. Biochem., 242(1), pp. 84-89.
- Sanger, F. et al. (1977), «DNA sequencing with chain-terminating inhibitors», Proc Natl Acad Sci USA, 74(12), pp. 5463-5467.
- Sboner, A. et al. (2011), «The real cost of sequencing: higher than you think!» Genome Biology, 12:125.
- Service, R.F. (2006), «Gene sequencing. The race for the $1000 genome», Science, 311(5767),pp. 1544-1546.