Un drammatico aumento delle malattie metaboliche
Negli ultimi anni si è assistito a un drammatico aumento delle malattie correlate all’alterazione del metabolismo, causando condizioni quali obesità, diabete di tipo 2 (T2D), malattie cardiovascolari e sindrome metabolica (MetS).
Oltre ai numerosi fattori a cui è stato attribuito questo aumento, quali la dieta, l’attività fisica e l’infiammazione, numerosi studi forniscono evidenza di una correlazione tra microbiota intestinale e malattie metaboliche.
Obiettivo del presente articolo è fare un focus sulle conoscenze relative al rapporto tra microbiota intestinale e malattie metaboliche senza avere alcuna pretesa di essere esaustivo dell’argomento, ma di essere uno stimolo ad affacciarsi ad un nuovo e complesso campo di studio sicuramente in divenire.
Negli ultimi dieci anni, la mole di studi pubblicati che forniscono evidenze sul rapporto tra microbiota intestinale e malattie metaboliche ha avuto una notevole impennata rispetto a venti anni fa. La capacità di comprendere il microbiota e di poterlo modulare potrebbe rappresentare la nuova frontiera per la prevenzione e la terapia delle principali malattie metaboliche quali il diabete di tipo 1, il diabete di tipo 2, la sindrome metabolica e l’obesità.
Microbiota e metabolismo
Il microbiota svolge un ruolo importante in molte funzioni metaboliche, tra cui la modulazione della glicemia e l’omeostasi lipidica, la regolazione della sazietà, la produzione di energia e di vitamine. Esercita un ruolo nella regolazione di numerosi meccanismi biochimici e fisiologici attraverso la produzione di metaboliti e sostanze. Inoltre, il microbiota svolge anche importanti azioni anti-infiammatorie.
Vi sono prove crescenti che modifiche nella composizione del microbiota possono portare a diverse patologie, comprese le malattie metaboliche, come l’obesità e il diabete, e le malattie cardiovascolari. È interessante sottolineare come le attuali e future strategie preventive e terapeutiche per prevenire queste malattie puntino decisamente su un’adeguata modulazione del microbiota.
Il microbiota umano
Il microbiota è un ecosistema complesso di microrganismi costituito da batteri, virus, protozoi e funghi, che vivono in diversi distretti del corpo umano, quali il tubo gastroenterico, la pelle, la bocca, il sistema respiratorio e la vagina.
Oltre il 70% del microbiota vive nel tratto gastrointestinale in una relazione reciprocamente vantaggiosa con il suo ospite.
La composizione quali-quantitativa dei microrganismi varia nei diversi tratti dell’apparato digerente. In particolare a livello gastrico è possibile isolare una concentrazione pari circa a 103 CFU/ml.
Tale concentrazione cresce progressivamente nell’intestino tenue fino a circa 102-109 CFU/ml e nel grosso intestino si raggiungono concentrazioni pari circa a 104-1012 CFU/ml.
Tali specie batteriche appartengono principalmente ai phyla dei Firmicutes e dei Bacteroidetes, entrambi derivanti da un precursore comune: Methanobrevibacter smithii.
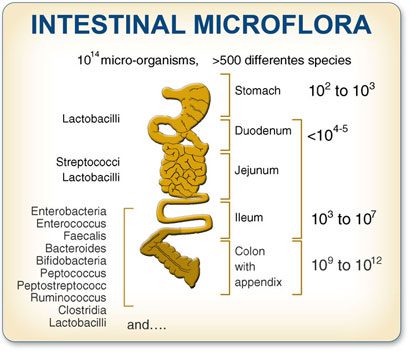
Figura 1 – Composizione del microbiota intestinale nei diversi distretti anatomici
I batteri che compongono il microbiota intestinale sono oltre 1000 specie, con un peso complessivo di circa 1.5 kg, pari a quello di un organo umano, e appartengono a più di 15000 ceppi differenti.
È possibile dire che “il microbiota intestinale umano ha un’attività metabolica pari ad un organo nell’organo” ed attraverso tale attività lo stesso esplica determinate funzioni benefiche per l’ospite, quali la produzione di metaboliti essenziali, la formazione di massa fecale e gas intestinale, la modulazione immunitaria comprendente anche un’attività antibiotica, la degradazione di xenobiotici, e la funzione metabolica riguardante la digestione e l’assorbimento di nutrienti.
Backhed ed altri autori, nel 2004 affermarono: “Il microbiota può essere considerato come un organo metabolico squisitamente convertito alla nostra fisiologia che svolge funzioni che non siamo in grado di svolgere altrimenti”.
Tali funzioni includono la capacità di assimilare componenti altrimenti indigeribili della nostra dieta, come i polisaccaridi vegetali.
Il microbiota viene influenzato dall’alimentazione, dallo stile di vita, dall’esercizio fisico, dall’uso degli antibiotici e dalla genetica.
Il microbiota interviene nella regolazione della produzione di acidi grassi a catena corta (SCFA) coinvolti nella regolazione dell’assorbimento del cibo e della modulazione insulinica nella generazione di un basso grado di infiammazione.
La colonizzazione dell’intestino inizia ancor prima del parto ed i primi tre anni di vita sembrano fondamentali per il corretto sviluppo del sistema immunitario.
Lo squilibrio del microbiota intestinale conduce alla cosiddetta “disbiosi intestinale” che sembra essere coinvolta nello sviluppo delle maggiori patologie immuno-mediate.
Anche la modalità del parto può determinare il microbiota del nascituro. I bambini nati con parto spontaneo assumono parte del microbiota vaginale mentre i bambini nati tramite parto cesareo hanno un imprinting diverso con una minore diversificazione del microbiota.
Inoltre i bambini nati prematuri hanno un microbiota caratterizzato da scarsa diversità, instabilità e maturazione ritardata. Infine anche l’allattamento al seno influisce sullo sviluppo del microbiota in modo differente rispetto all’allattamento con latti umanizzati. Gli oligosaccaridi del latte umano (HMO) sono considerati essere in grado di fungere da fattori di crescita per i batteri intestinali benefici nel lattante.
Il microbiota intestinale ha una grande resilienza e quindi tende a tornare alle condizioni di partenza dopo la fine dell’evento perturbante.
Pertanto, per modulare il nostro microbiota dobbiamo pensare a degli interventi molto lunghi per evitare un rapido ritorno alla disbiosi di partenza.
In altre parole, gli antibiotici possono indurre dei cambiamenti del microbiota anche a lungo termine. Il principale fattore ambientale per la modulazione del microbiota è forse l’alimentazione.
I carboidrati indigeriti o non completamente digeriti sono importanti substrati alimentari per il microbiota. Per esempio ritroviamo tra questi, gli amidi complessi e le fibre alimentari, come la cellulosa e l’emicellulosa, che comprende gli xilani, come la crusca, i glucomannani, e le pectine. I lipidi, invece, non possono essere utilizzati dai batteri anerobi intestinali, in quanto l’ossidazione degli acidi grassi a lunga catena richiede la presenza di ossigeno, che è scarso a livello intestinale.
Microbiota e diabete mellito di tipo 2
Alcuni studi hanno esaminato se un microbiota intestinale alterato può direttamente influenzare questa patologia. Gli scienziati dell´Università di Göteborg, hanno dimostrato che il microbiota intestinale di persone con diabete di tipo 2 può essere collegato a un diverso metabolismo dell’aminoacido istidina, che deriva principalmente dalla dieta. Tale amminoacido, a sua volta, porta alla formazione di acido imidazol-propionico, una sostanza che altera la capacità delle cellule di rispondere all’insulina.
Ridurre la quantità di imidazolo propionato prodotto dai batteri potrebbe quindi essere un nuovo modo di trattare i pazienti con diabete di tipo 2. “Questa sostanza non causa tutti i tipi di diabete di tipo 2, ma la nostra ipotesi di lavoro è che ci sono sottopopolazioni di pazienti che potrebbero trarre beneficio dal cambiamento della loro dieta o dall’alterazione del loro microbiota intestinale per ridurre i livelli di imidazolo propionato”, afferma Fredrik Bäckhed, professore di Medicina Molecolare esperto nella ricerca sul ruolo del microbiota intestinale nelle malattie metaboliche.
I ricercatori hanno identificato un’elevata concentrazione della sostanza imidazolo propionato in pazienti con diabete di tipo 2. Utilizzando campioni fecali, è stato anche possibile dimostrare che il microbiota di persone con diabete di tipo 2 produceva imidazolo propionato quando era stata aggiunta istidina. Tale meccanismo non è stato riscontrato nei soggetti di controllo senza diabete.
Figura 2 – Rapporto tra il microbiota e il diabete di tipo 2
I batteri Gram negativi, come i Bacteriodes, contengono grandi quantità di lipopolisaccaride (LPS) , un forte attivatore dei recettori TLR4 (Toll like receptor 4), espressi in moltissime cellule somatiche e del SNC così come sui macrofagi.
Il legame tra gli LPS e i TLR4 innesca una risposta infiammatoria e l’espressione e la secrezione di citochine.
Nei soggetti obesi i livelli circolanti di LPS sono molto alti e questo incremento è direttamente correlato all’incremento della permeabilità intestinale dovuto ad una diminuzione delle “tight junction” intestinali. I LPS sono trasportati dai chilomicroni nella circolazione.
L’aumento dei LPS è uno dei fattori che induce infiammazione, come già detto, così come l’insulino-resistenza, intolleranza al glucosio e obesità.
Il microbiota può influire anche sull’assorbimento dei monosaccaridi. Alcuni ceppi batterici possono indurre una maggiore espressione degli SGLT-1 a livello ileale, mentre altri ceppi possono indurre l’incremento dell’espressione dei GLUT-2 a livello del digiuno e dell’ileo.
Microbiota e diabete mellito di tipo 1
L’incidenza del diabete mellito di tipo 1 (DMT1) sta crescendo in tutti paesi industrializzati dalla fine del secondo conflitto mondiale.
Tale incremento non può essere spiegato con il solo aspetto genetico.
Infatti i bambini migranti provenienti da popolazione a basso rischio di sviluppo di DMT1, assumono lo stesso rischio delle popolazioni ad alto rischio.
Sicuramente i virus sembrano implicati nello sviluppo del DMT1, ma la relazione causa-effetto tra infezione e malattia non è ancora stata stabilita.
Come già detto, l’uso di antibiotici causa cambiamenti anche a lungo termine e la dieta occidentale, ad alto contenuto di grassi, ad alto tenore di carboidrati semplici e con un basso apporto di fibre, può indurre sostanziali cambiamenti funzionali a livello del microbiota intestinale.
Questi dati suggeriscono che i bambini non affetti da DMT1 potrebbero aver avuto un microbiota più bilanciato e stabile rispetto ai bambini che hanno sviluppato il DMT1.
Microbiota e obesità
Un chiaro esempio di rapporto tra di una correlazione tra microbiota intestinale e malattie metaboliche ci viene offerto dall’obesità che è una patologia multifattoriale derivante dall’interazione della genetica individuale con l’ambiente con una prevalenza nel mondo che sta salendo in modo sempre più marcato a partire dagli anni ’70-’80.
Soprattutto il cibo sempre più conveniente, di facile reperibilità, ad alta densità energetica e di scarsa qualità e l’eccesso di alimentazione sono tra le cause più rilevanti nel determinare un notevole aumento dell’obesità.
Gli stessi fattori hanno anche una notevole importanza nell’alterazione del microbiota. Anche se l’obesità e le malattie metaboliche sono da sempre considerati disturbi legati alla nutrizione, recenti evidenze dimostrano che il microbiota intestinale gioca un ruolo importante nello sviluppo di questa malattia metabolica.
Studi recenti hanno suggerito che il microbiota delle persone obese possa aiutare il corpo ad aumentare la quantità di energia che viene estratta dal cibo, suggerendo che certe componenti del microbiota intestinale possono aumentare la probabilità di diventare obesi.
Sebbene molta della ricerca sia ancora agli inizi, tuttavia, gli studi hanno rivelato che le persone obese tendono ad avere una differente composizione dei batteri intestinali paragonati ad individui magri.
Nell’anno 2006 è uscito uno dei primi studi che ha confermato il rapporto tra microbiota, incremento ponderale e obesità, rapporto determinato dalla capacità del microbiota di rendere disponibile per l’ospite una maggiore quantità di energia assimilabile.
Lo studio dimostrava che il trapianto di microbiota da topi geneticamente obesi con genotipo ob/ob in topi germ-free, causava un incremento ponderale; tale incremento non si evidenziava quando veniva trapiantato il microbiota di topi non obesi, a parità di assunzione di cibo.
Studi su gemelli omozigoti discordanti per il peso hanno favorito di determinare la correlazione tra microbiota, peso e alimentazione.
I soggetti con fenotipo obeso e con minore ricchezza batterica hanno una riduzione dei batteri che producono butirrato, una minore produzione di metano e idrogeno, un incremento dello stress ossidativo, cui conseguiva una maggiore tendenza a sviluppare quadri infiammatori.
Il microbiota intestinale influenza il metabolismo dell’ospite attraverso diversi meccanismi tra i quali: l’estrazione di energia da alcuni nutrienti, la modulazione del metabolismo lipidico, l’alterazione delle funzioni endocrine e l’aumento del livello infiammatorio.
L’obesità è stata associata con un microbiota intestinale alterato caratterizzato da livelli elevati di Firmicutes e bassi livelli di Bacteroides.
La dieta occidentale (alto tenore di grassi saturi, bassa presenza di fibre, ecc.) induce una riduzione dei ceppi dei Bacteroidetes e favorisce lo sviluppo dei ceppi dei Firmicutes, coinvolti nel metabolismo dei carboidrati.
Il microbiota di soggetti obesi ha una prevalenza di Firmicutes, mentre il microbiota di soggetti magri ha una prevalenza di Bacteroidetes con elevato rapporto Bacteroidetes/Firmicutes.
Uno dei ceppi batterici più importanti nella prevenzione dell’obesità è l’Akkermansia muciniphila, che appartiene al gruppo dei Verrucomicrobia.
Molti studi descrivono una correlazione inversa tra la concentrazione di Akkermansia muciniphila e modelli di obesità genetica e alimentare.
La somministrazione di prebiotici, fibre alimentari come l’inulina e i suoi derivati, induce un netto incremento dell’Akkermansia in topi geneticamente obesi, con un miglioramento delle funzioni metaboliche e del metabolismo glucidico.
Il microbiota influenza la fermentazione dei carboidrati indigeribili in acidi grassi a catena corta (SCFA: acido butirrico, acido acetico, e propionico).
L’acido butirrico e il propionico hanno un effetto anti-obesogeno mentre l’acido acetico ha effetto opposto.
Infatti i primi due sono principalmente prodotti dai Bacteroidetes mentre il terzo dai Firmicutes.
L’acido butirrico stimola il rilascio da parte delle cellule L del GLP-1 e del GIP migliorando l’insulino sensibilità. L’acido propionico ha effetti positivi sull’inibizione del funzionamento dell’Acetil-CoA sintetasi e quindi effetto sulla sintesi del colesterolo. L’acido acetico è invece substrato per la lipogenesi e per la sintesi di colesterolo.
Microbiota e strategie di modulazione
I prebiotici sono definiti come carboidrati fermentabili ma non digeribili dall’uomo in grado di influenzare il microbiota intestinale al fine di indurre un beneficio salutare all’ospite.
Tra i benefici dimostrati si evidenziano un miglioramento del segnale insulinico e della sua produzione. Tra i prebiotici troviamo l’inulina, gli amidi resistenti e gli oligosaccaridi.
L’uso di prebiotici è in grado di modulare lo sviluppo anche in modo importante di molti ceppi batterici e in particolare dei Bacteroidetes a discapito dei Firmicutes, favorendo quindi un rapporto tra i ceppi batterici come quello che si ritrova nel microbiota dei soggetti magri.
Inoltre i prebiotici hanno dimostrato di migliorare molti parametri metabolici come i livelli della glicemia a digiuno, la tolleranza glicidica, la riduzione dei livelli plasmatici dei trigliceridi, l’infiltrazione lipidica dei muscoli, la massa del tessuto adiposo, lo stress ossidativo e di migliorare la sensibilità leptinica.
I prebiotici modulano anche la secrezione del GLP-1 e del GLP-2, ed accrescono la sensazione di sazietà, con effetti sull’appetito e sulla risposta glucidica dopo il pasto.
I probiotici sono microrganismi viventi che possono migliorare la salute dell’ospite modificando il microbiota dopo essere stati assunti.
Il Lactobacillus casei induce un decremento dei livelli glicemici nei topi affetti da diabete tipo 1 e previene l’insorgenza di diabete tipo 2 nei modelli murinici. La somministrazione di probiotici ha dimostrato di ridurre la distruzione delle β-cellule, di ridurre il danno ossidativo del pancreas, di manifestare proprietà anti-infiammatorie, di ridurre la traslocazione batterica tra l’intestino e l’ospite e di ridurre l’espressione delle citochine pro-infiammatorie.
Conclusioni
Numerose ricerche sul microbiota intestinale umano dimostrano che la dieta può fungere da modulatore della composizione e della funzione di questa comunità microbica nell’uomo e negli animali.
In conclusione le modifiche del microbiota che riscontriamo nell’obesità, nella sindrome metabolica, nel diabete tipo 1 e 2 potrebbero rappresentare un potenziale target terapeutico: l’utilizzo di terapie ad azione prevalentemente locale, con effetti sistemici, potrebbe diventare una nuova prospettiva di intervento positivo sulla correlazione microbiota intestinale e malattie metaboliche.
È evidente che i meccanismi attraverso i quali il microbiota regola il metabolismo dell’ospite sono molto complessi ed in futuro, probabilmente, verranno identificate nuove vie metaboliche.
Alla luce dei dati di cui disponiamo appare chiaro che, se nutriremo il nostro microbiota ottimizzando la dieta, riducendo l’uso degli antibiotici e recuperando il contatto con i prodotti che ci offre la natura, miglioreremo il benessere di questa comunità microbica e quindi il nostro stato di salute.
Su questa base, la modifica del microecosistema intestinale può essere preso come un obiettivo chiave per raggiungere gli effetti profilattici o terapeutici in condizioni alterate metaboliche e negli stati infiammatori.
Sfruttare questa conoscenza a nostro vantaggio potrebbe aiutarci a rimanere sani più a lungo.
In questo modo si forniscono anche spunti fondamentali per lo sviluppo di nuovi alimenti e modelli alimentari che mirino all’ottimizzazione delle attività microbiche nel nostro intestino per un adeguato sfruttamento di questa enorme risorsa che ogni essere umano possiede.
Il nostro messaggio di nutrizione deve pertanto continuare ad essere quello di aumentare il consumo di carboidrati complessi che svolgono azione benefica sul nostro microbiota.
Considerato che la dieta del mondo moderno ha modificato in negativo il nostro microbiota dovremmo quindi ripensare davvero al nostro modo di mangiare e di vivere, mettendo tra le nostre priorità il benessere dell’intestino.
Certamente ci sono ancora molte lacune nella nostra comprensione delle interazioni tra dieta e stile di vita, microbi e salute quindi del rapporto tra microbiota intestinale e malattie metaboliche.
In questo articolo sono state presentate alcune delle aree che certamente dovranno essere approfondite per contribuire a colmare tale divario di conoscenze.
L’implicazione più interessante di tutto questo è che, anche se in parte lo possiamo fare già adesso, un giorno potremo forse sapere esattamente come indirizzare la nostra alimentazione allo scopo di potere “modellare” il nostro microbiota per migliorare la nostra salute.
Pertanto, possiamo rivedere il vecchio aforisma del filosofo Fuerbach, sostenendo che non siamo direttamente ciò che mangiamo o quello che nostra madre mangia, ma siamo quello che il nostro microbiota mangia e come viene modificata dalla dieta la composizione collettiva del nostro microbiota.
Allo stato attuale siamo ancora lontani dal poter dire che abbiamo compreso tutto sul rapporto tra microbiota intestinale e malattie metaboliche ma certamente siamo consapevoli che attraverso il microbiota si possano curare molte malattie dell’uomo.
Pertanto, resta comunque il fascino di questa grande sfida scientifica che sicuramente potrà aprire in un futuro prossimo nuovi scenari e forse potrà dare grandi risposte che ci consentiranno, con buona probabilità, di scrivere nei prossimi anni importanti pagine della storia della medicina.
Giuseppe Chindemi
Fonti
- Karlsson C.L., Onnerfält J., Xu J., Molin G., Ahrné S., Thorngren-Jerneck K. “The microbiota of the gut in preschool children with normal e and excessive body weight”. Obesity (Silver Spring) 20:2257-61, 2012.
- Bäckhed F., Ding H., Wang T., Hooper L.V., Koh G.Y., Nagy A., Semenkovich C.F., Gordon J.I. “The gut microbiota as an environmental factor that regulates fat storage” Procedings of the National Academy of Sciences of the United States of America 2004; vol.101, n°44
- Eckburg P.B., Bik E.M., Bernstein C.N., et al. “Diversity of the human intestinal microbial flora”. Science 2005;308: 1635-8.
- Everard A., Belzer C., Geurts L., Ouwerkerk J.P., Druart C., Bindels L.B., et al. “Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet induced obesity”. Proc Natl Acad Sci USA 110:9066-71, 2013.
- Flint H.J., Scott K.P., Duncan S.H., Louis P., Forano E. “Microbial degradation of complex carbohydrates in the gut”. Gut Microbes 3:289-306, 2012.
- Hara N., Alkanani A.K., Ir D., Robertson C.E., Wagner B.D., Frank D.N., Zipris D. “Prevention of virus induced type 1 diabetes with antibiotic therapy”. J Immunol 189:3805-14, 2012.
- Tremaroli V., Bäckhed F. “Functional interactions between the gut microbiota and host metabolism”. Nature 2012; 489:242-249.
- Turnbaugh P.J., Ley R.E., Mahowald M.A., Magrini V., Mardis E.R., Gordon J.I. “An obesity-associated gut microbiome with increased capacity for energy harvest”. Nature 444(7122):1027-31, 2006.
Molto interessante