Premessa
Il sistema immunitario (SI) è un’apparato straordinariamente complesso ed efficace, in grado di distinguere i microrganismi patogeni da quelli che risiedono normalmente nel nostro intestino, noti meglio come microbiota intestinale.
Il fatto che i circa 100 trilioni di microrganismi appartenenti al microbiota non vengano attaccati dal nostro SI, al contrario di quanto avviene per i microbi patogeni, si deve alla complessa e dinamica interazione evolutasi nell’arco di quasi 500 milioni di anni, proprio tra questi speciali microrganismi e l’essere umano.
Questa interazione ha portato il sistema immunitario e il microbiota intestinale ad un adattamento reciproco molto vantaggioso per la nostra salute.
Oggi vi sono pochi dubbi sul fatto che il SI dell’uomo dipenda strettamente dalle istruzioni che riceve continuamente dal proprio microbiota, il quale svolge un ruolo chiave nello sviluppo, addestramento e funzionamento delle nostre difese.
Fino a quando l’alleanza tra il nostro SI ed il microbiota è in perfetto equilibrio, essa determina una risposta protettiva contro i patogeni ed il mantenimento della “tolleranza” nei confronti di antigeni innocui.
Il microbiota e l’interazione con il sistema immunitario inizia dalla nascita
Il microbiota si sviluppa già durante la gravidanza e poi, al momento della nascita, il neonato viene a contatto con parte dei batteri materni andando, via via, diversificandosi durante lo sviluppo.
Numerosi studi hanno ormai dimostrato come questa colonizzazione batterica, nei primi 3 anni di vita, sia determinante per lo sviluppo del sistema immunitario (SI): durante questa cosiddetta “finestra di opportunità”, il SI “impara” a funzionare anche grazie all’interazione con il microbiota (soprattutto con quello intestinale), che funge da vera e propria palestra per le difese immunitarie, determinando in modo duraturo una maggiore o minore suscettibilità a patologie o infezioni nella vita adulta.
Ma quali sono i fattori collegati a una maggiore varietà e ricchezza del microbiota?
Le evidenze scientifiche sembrano indicare che soprattutto il parto per via naturale e l’allattamento al seno favoriscono una maggiore diversità del microbiota, mentre il parto cesareo e l’uso di antibiotici nei primi mesi di vita sembrano impoverirlo. Molti modelli sperimentali hanno dimostrato che organi e strutture del SI non si sviluppano correttamente se l’organismo non viene a contatto con i microrganismi.
Questo aspetto è molto importante se si pensa che l’apparato digerente dell’uomo, intestino tenue in particolare, è il punto di maggior concentrazione di cellule immunitarie di tutto l’organismo. Ecco perché esiste uno stretto legame tra microbiota intestinale e SI.
D’altra parte, il ruolo centrale del microbiota intestinale nello sviluppo del SI e nella modulazione della sua funzione non dovrebbe sorprendere, se teniamo presente che la mucosa intestinale è la più ampia superficie dell’organismo a contatto con microbi e antigeni e che la popolazione dei microbi intestinali ha un’interazione diretta e intensa con la mucosa e con i suoi sistemi di difesa.
Durante la vita la mucosa intestinale viene a contatto con un numero incalcolabile di antigeni (batteri, virus, parassiti, antigeni alimentari, farmaci e diversi altri composti chimici); pertanto è di fondamentale importanza la presenza di difese che assicurino un’adeguata protezione.
Questo sistema complessivamente prende il nome di barriera intestinale.
Una parte fondamentale di questo effetto barriera viene svolto dal tessuto linfoide associato all’intestino (GALT), costituito prevalentemente da linfociti T, che costituiscono circa un sesto delle cellule dei villi, da linfociti B, cellule dendritiche e plasmacellule (secernenti prevalentemente Ig A) presenti nel connettivo della lamina propria e da follicoli linfatici isolati (più frequenti nel colon) o aggregati (placche del Peyer, nell’ileo).
Il ruolo fisiologico del microbiota intestinale si evidenzia dagli studi sugli animali “germ free”.
In questi animali l’epitelio intestinale ed i villi sono più sottili e con poche cellule cubiche, le cripte sono poco profonde ed il turnover cellulare è ridotto.
Inoltre, anche la produzione e gli effetti delle citochine risultano alterati negli animali che non hanno un contatto normale con i microrganismi.
Azione di modulazione del microbiota sul sistema immunitario
L’esempio più tipico dell’importanza della colonizzazione intestinale sullo sviluppo di una corretta risposta immunitaria è rappresentato dallo sviluppo della tolleranza orale: nel soggetto normale l’ingestione di un antigene non determina una risposta sistemica mediata da Ig E; ciò avviene invece negli animali germ-free, e la colonizzazione dell’intestino in età neonatale (ma non in età adulta) corregge tale anomalia.
Questa osservazione sottolinea l’importanza che la colonizzazione avvenga in età neonatale: lo stabilirsi di un microbiota appropriato in tempi fisiologici, quale quello che si sviluppa con l’alimentazione al seno, favorisce l’evoluzione di una risposta immunitaria adeguata.
Esiste un equilibrio tra stimolazione antigenica e risposta immunitaria.
Una risposta immunitaria particolarmente aggressiva, indotta da componenti antigeniche del microbiota in soggetti geneticamente predisposti, è alla base delle malattie infiammatorie croniche intestinali, così come una risposta debole rispetto all’aggressività batterica induce sovracrescita e diffusione dei batteri nell’organismo (traslocazione).
Alcuni microrganismi sono in grado di influenzare il GALT (insieme delle cellule immunitarie associate alla parete intestinale) nel contrastare i germi patogeni presenti nell’intestino, svolgendo un’azione protettiva ancora più marcata.
I batteri commensali possono indurre la differenziazione delle cellule CD4+ in quattro sottotipi principali: Th1, Th2, Th17 e Treg; l’azione del microbiota è quella di regolare il corretto equilibrio tra queste quattro sottopopolazioni linfocitarie.
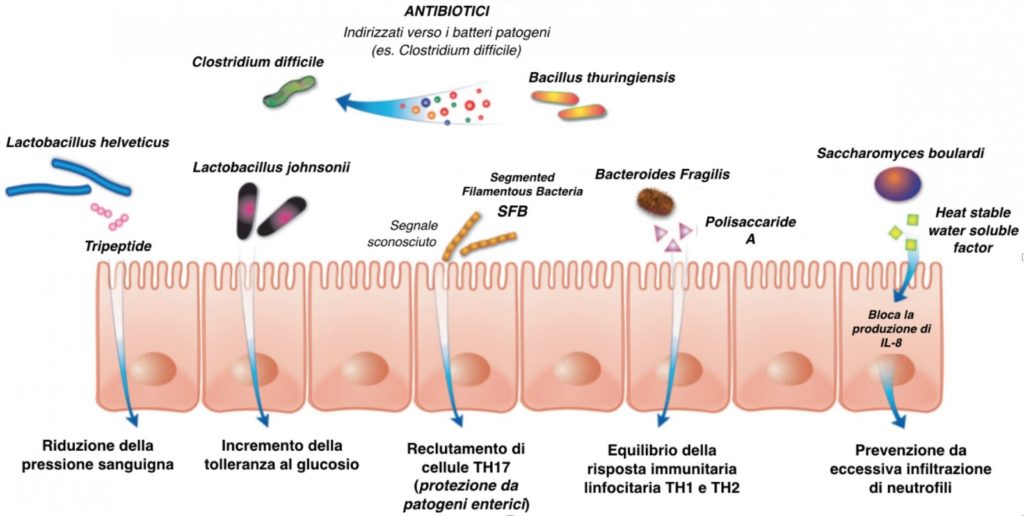
Fra i meccanismi messi in atto dal sistema immunitario utilizzati per controllare e contenere lo sviluppo delle colonie batteriche vi è la produzione di Ig A secretorie che rivestono il microbiota e permettono di controllarne la crescita, evitando che questa diventi eccessiva.
Tali anticorpi sono prodotti da plasmacellule, che a loro volta sono attivate da cellule chiamate dendritiche, simili ai macrofagi, localizzate nella parete intestinale.
I batteri filamentosi (SFB) possono indurre la crescita delle cellule Th17 e Th1, mentre i Clostridium stimolano la crescita delle cellule Treg e la produzione della citochina IL-10 che svolge azione antinfiammatoria.
Anche Bacteroides fragilis ha dimostrato un buon effetto nel mantenere l’equilibrio del SI tanto da diventare uno dei modelli maggiormente studiati nel rapporto simbiotico tra sistema immunitario e microbiota.
Si è visto che il polisaccaride A prodotto da B. fragilis stimola la produzione di IL-10 e di Treg così come risulta efficace nel mantenimento dell’equilibrio Th1/Th2.
Quando il microbiota perde in ricchezza e diversità, e va incontro a quel processo che viene definito “disbiosi”, il SI dell’ospite inizia a perdere di efficacia e precisione al punto da reagire in maniera incongrua, per eccesso, per difetto, o talora contro l’oggetto sbagliato (come avviene nella malattie autoimmuni).
Correlazioni tra microbiota, sistema immunitario e fattori dietetici
Un altro aspetto interessante riguarda la capacità del microbiota intestinale e di metaboliti da esso prodotti di influenzare la capacità delle cellule immunitarie killer CD8+ di differenziarsi nelle cellule immunitarie della memoria (in assenza di microbiota, le cellule killer non riescono a dare origine alle cellule della memoria).
Poiché i microbi intestinali producono molti metaboliti che influenzano e regolano la fisiologia dell’ospite, alcuni ricercatori australiani hanno testato se l’aumento dei livelli di SCFA (acidi grassi a catena corta) nei topi fosse in grado di migliorare la capacità di memoria delle cellule T CD8 + attivate.
Per fare ciò, hanno alimentato i topi con una dieta ricca di fibre, registrando un incremento di 100 volte dei livelli di butirrato circolante.
L’aumento dei livelli di SCFA come il butirrato ha potenziato la capacità delle cellule killer di sopravvivere e di formare cellule della memoria.
I metaboliti derivati dal microbiota hanno promosso la differenziazione delle cellule immunitarie attivate modificando anche il loro metabolismo nel senso di sviluppare la capacità a fare meno affidamento sugli zuccheri e a utilizzare, invece, i grassi.
Questo interruttore è fondamentale per la loro sopravvivenza a lungo termine, in quanto le cellule che si basano solo sulla combustione del glucosio non riescono a sopravvivere, secondo gli studiosi.
Questa stessa sostanza sembra inoltre in grado di stimolare nell’organismo umano la produzione di linfociti T regolatori, di grande importanza per la risposta immunitaria.
Nella disbiosi intestinale, causata da una dieta sbilanciata, da antibiotici, da stress psicologico e fisico, avvengono alterazioni nel metabolismo batterico, così come la sovracrescita di microrganismi potenzialmente patogeni; le cellule T infiammatorie, tipo Th1 e Th17 aumentano, e le cellule Treg diminuiscono.
Il microbiota intestinale ed il SI sono sensibili al cambiamento della dieta; il controllo dietetico delle cellule immunitarie è mediato dai recettori sensibili ai metaboliti derivanti dal cibo.

Ad esempio, l’acido retinoico, metabolita della vitamina A, controlla la capacità dei linfociti di rispondere agli antigeni e migrare verso il tratto gastrointestinale. Anche i ligandi alimentari per l’AhR (aryl hydrocarbon receptor), presenti in particolare nelle crucifere, sono importanti segnali per lo sviluppo del SI intestinale e per le risposte immunitarie.
Conclusioni
Il microbiota intestinale svolge un ruolo chiave nel processo di maturazione del sistema immune, in particolare durante il periodo neonatale, ed è influenzato per tutta la vita da fattori ambientali.
Nei paesi occidentalizzati il largo uso di terapie antibiotiche, uno stile alimentare troppo ricco di cibi processati, l’abbondante utilizzo di prodotti disinfettanti per garantire un’igiene forse eccessiva, ha portato ad una diminuzione della diversità microbica che è necessaria a mantenere una risposta immunitaria equilibrata.
Questi fattori potrebbero giustificare il preoccupante incremento di patologie infiammatorie croniche o su base autoimmune che viene registrato soprattutto in questi paesi occidentali.
Insomma, per avere un microbiota ricco, ovvero nel quale le diverse specie di microrganismi sono rappresentati, sono fondamentali i primi anni di vita; solo in questo modo il sistema immunitario potrà svilupparsi correttamente.
È stato inoltre suggerito che un sano microbiota si sviluppa quando c’è un corretto bilanciamento tra organismi simbionti, commensali e patobionti.
Alterazioni di questo equilibrio conducono al fenomeno della disbiosi, che è stata implicata in numerose patologie intestinali ed extra-intestinali.
L’evidenza epidemiologica suggerisce inoltre che la modulazione dei meccanismi della risposta immune nell’intestino può influenzare in senso positivo lo sviluppo dei meccanismi alla base di malattie allergiche sia respiratorie che sistemiche.
Un aspetto cruciale è che la composizione di un sano microbiota richiesta per conferire la massima protezione non è nota.
Questo aspetto rappresenta un obiettivo della ricerca, indirizzata a stabilire se i differenti arrangiamenti microbici che sorgono da specifiche diete si traducono realmente nella modulazione della funzione immune.
I risultati relativi a possibili effetti di batteri intestinali selezionati o probiotici sulla maturazione e la funzionalità di cellule immuni, come anche su mediatori inducibili vengono raccolti al fine di stabilire il grado di modulazione del fenotipo della risposta immune indotta. Considerando l’interdipendenza della dieta, del sistema immunitario e del microbiota, un’importante sfida per gli anni avvenire sarà sicuramente sviluppare strategie sperimentali finalizzate a definire i regolatori dietetici critici per questa complessa ed interdipendente rete.
Giuseppe Chindemi
Fonti
- Gensollen T, et al. “How colonization by microbiota in early life shapes the immune system”. Science, volume 352; 2016issue 6285, pp 539-544.
- Purchiaroni F., Tortora A., Gabrielli M., Bertucci F., Gigante G., Ianiro G., Ojetti V., Scarpellini E., Gasbarrini A. “The role of intestinal microbiota and the immune system”. Eur. Rev. for Med. and Pharmacol. Sci. 2013; 17: 323-333 Rescigno, M. “Intestinal microbiota and its effects on the immune system”. Cell. Microbiol., volume 16, issue 7; 2014 pp.1004–13.
- Rescigno, M. “Intestinal microbiota and its effects on the immune system”. Cell. Microbiol., volume 16, issue 7; 2014 pp.1004–13.
Buongiorno dottor Centorrino, ho trovato molto interessante il suo articolo. Anche se mi mancano alcune basi di biochimica, trovo “affascinante” tutto ciò che riguarda il Microbiota Intestinale e il
funzionamento del sistema immunitario in genere. Grazie