La biologia sintetica
La biologia sintetica o synbio è quel ramo scientifico della biologia che ha come obiettivo la creazione in laboratorio di (micro)organismi artificiali e/o la sintesi efficace e veloce di lunghe sequenze di DNA senza utilizzare alcun modello naturale.
Erano i primi anni 2000 quando il John Craig Venter Institute (JCVI), allora chiamato The Institute for Genomic Research (TIGR), avviò il progetto di ricerca sulla creazione della prima cellula sintetica con DNA minimo in grado di sopravvivere ed auto-replicarsi.
Dopo quasi vent’anni di ricerca scientifica in questo settore, da parte di ricercatori di tutto il mondo, oggi le cellule artificiali stanno diventando sempre più simili a quelle biologiche.
Un esempio di tale avanzamento scientifico è rappresentato dagli xenobot, considerati i primi “robot viventi” in grado di riprodursi.
Cos’è uno xenobot?
Uno xenobot (Fig. 1) è un organismo pluricellulare semi-sintetico progettato con l’ausilio di un calcolatore affinché svolga una funzione desiderata e realizzato combinando insieme diversi tessuti biologici.
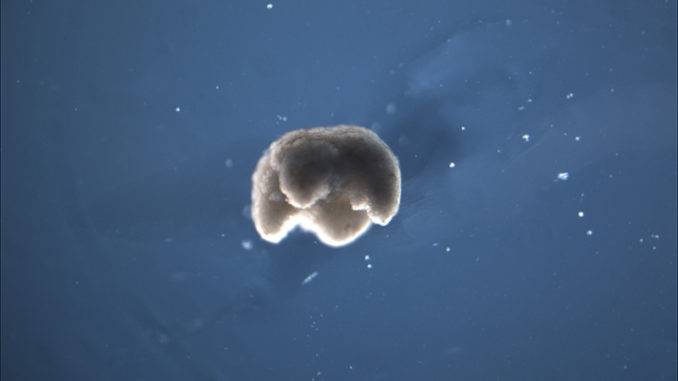
Lo xenobot prende il nome dallo xenopo liscio o platanna (Fig. 2), una rana acquatica endemica dell’Africa australe, poiché la sua creazione avviene a partire dalle cellule di questo organismo.

Lo xenopo liscio rappresenta un importante organismo modello negli studi di biologia evolutiva dello sviluppo e di biologia sintetica.
Gli xenobot sono organismi delle dimensioni di circa un millimetro costituiti da poche migliaia di cellule (circa 3000). Essi sono composti esclusivamente da cellule ectodermiche e miocardiociti derivanti da cellule staminali ricavate da embrioni di xenopo liscio allo stadio di blastula.
In particolare, le cellule ectodermiche fungono da “scheletro”, ossia forniscono un supporto rigido, mentre i miocardiociti fungono da “piccoli motori”, assicurando il movimento allo xenobot mediante contrazioni ed espansioni.
La forma dello xenobot e la distribuzione spaziale dei suoi tessuti vengono progettate da un software che utilizza un algoritmo evolutivo in grado di correlare una determinata struttura 3D ad una precisa attività biologica.
Infatti, grazie a diversi algoritmi di intelligenza artificiale sono stati progettati xenobot in grado di camminare, nuotare, trasportare carichi e lavorare assieme in gruppo allo scopo, ad esempio, di radunare detriti sparsi sulla superficie di una piastrina in modo da formare delle pile ordinate (Fig. 3).

Infine, gli xenobot possono sopravvivere per diverse settimane con un apporto nutritivo esterno e possono persino ripararsi dopo aver subito una lieve lacerazione.
La nascita degli xenobot
La nascita degli xenobot è stata annunciata nel gennaio 2020 da quattro ricercatori statunitensi, S. Kriegman, D. Blackiston, M. Levin e J. Bongard, divisi tra l’Università del Vermont, la Tufts e l’Istituto Wyss di Harvard.
Gli xenobot sono stati definiti come “organismi viventi programmabili” dai propri creatori, in quanto non sono né robot tradizionali, sebbene vengano creati in laboratorio, né una specie animale, nonostante siano costituiti da tessuti e siano in grado di compiere semplici funzioni biologiche.
Contrariamente alle tecnologie tradizionali su cui si basano le cellule sintetiche, gli xenobot non inquinano né durante il loro lavoro né durante la loro degradazione. Infatti, essi ricavano energia dal grasso e dalle proteine naturalmente presenti nei propri tessuti, caratterizzati da una durata di circa una settimana, finiti i quali gli xenobot si trasformano semplicemente in piccoli ammassi di cellule morte. Per cui, si tratta di “robot viventi” completamente biodegradabili e non tossici.
Per la loro creazione i ricercatori hanno usato il cluster di supercomputer “Deep Green” dell’Università del Vermont, in grado di far funzionare un complesso algoritmo evolutivo di intelligenza artificiale capace di creare migliaia di modelli di nuove forme di vita.
Tuttavia, la sfida più grande non è stata creare organismi artificiali viventi ma bensì robot microscopici in grado di assolvere ad un determinato compito. Per raggiungere ciascun obiettivo assegnato dai ricercatori, come per esempio la locomozione, il computer ha aggregato alcune centinaia di cellule in silico (ectodermiche o miocardiociti), in varie forme corporee, rispettando le leggi della biofisica e della biochimica. Dopo centinaia di simulazioni indipendenti, i modelli più promettenti sono stati selezionati per i test in vivo (Fig. 4).

La capacità di auto-riprodursi degli xenobot
Per le prove in vivo, i ricercatori hanno isolato le cellule staminali di xenopo per poi “assemblarle” al microscopio secondo il progetto elaborato dal supercomputer. Ciò che rende unici gli xenobot sono le forme anatomiche realizzate, mai osservate prima d’ora in natura, che consentono comunque alle cellule di interagire tra loro e formare tessuti specializzati.
Inoltre, nel novembre 2021, è stata annunciata l’osservazione di un fenomeno di riproduzione sviluppato autonomamente dagli xenobot e mai precedentemente osservato in natura. I risultati di questa scoperta sono stati pubblicati sulla rivista scientifica Proceedings of the National Academy of Sciences (PNAS).
Il principio di base di tale riproduzione è definito “replicazione cinetica”. Si tratta di un meccanismo noto finora solo a livello molecolare, e mai osservato né a livello cellulare né, tantomeno, a quello di organismo pluricellulare.
In particolare, gli xenobot appositamente disegnati dall’algoritmo evolutivo sono in grado di spostare e combinare cellule staminali disperse nel loro ambiente in modo da creare gruppi di cellule identici a se stessi. Si tratta di un fenomeno di “gestazione” che richiede pochi giorni, durante i quali le cellule assemblate “maturano”, diventando a tutti gli effetti delle nuove copie di xenobot in grado di muoversi e riprodursi.
Secondo gli autori della scoperta, ciò dimostra che l’ingegneria dell’intelligenza artificiale può progettare dei cluster cellulari in grado di replicarsi nel modo migliore e di svolgere contemporaneamente un lavoro utile.
Inoltre, i ricercatori hanno affermato che i risultati ottenuti aprono la strada a future tecnologie che potrebbero, mediante pochi stimoli esterni, diventare sempre più utili man mano che si auto-riproducono.
Xenobot e intelligenza artificiale
Il successo di questo innovativo processo riproduttivo si deve innanzitutto al tipo di cellule di partenza adoperate. Infatti, le staminali sono cellule totipotenti o pluripotenti, ossia non specializzate, che hanno la capacità di trasformarsi in diversi tipi cellulari a seconda delle necessità e degli stimoli chimici. Negli xenobot questo processo di trasformazione e maturazione richiede solo qualche giorno.
Il secondo contributo fondamentale si deve ai modelli di astrazione, ossia di design in silico, realizzati dal supercomputer Deep Green. Infatti, la nuova astrazione è chiamata “rete di produzione di modelli compositivi” (CPPN).
A differenza delle astrazioni attualmente accettate in biologia sintetica, come ad esempio i sistemi di riscrittura iterativa e le simulazioni di crescita cellulare, il CPPN mappa il fenotipo senza interazione locale, cioè ogni singolo componente del fenotipo è determinato indipendentemente da ogni altro componente.
I risultati prodotti con il CPPN, attraverso l’evoluzione interattiva di immagini bidimensionali, mostrano che tale codifica può comunque produrre motivi strutturali spesso attribuiti ad astrazioni evolutive più convenzionali. Ciò suggerisce che l’interazione locale potrebbe non essere essenziale per le proprietà desiderabili della codifica naturale nel modo in cui di solito si presume.
Grazie al Deep Green e al CPPN è stato possibile testare miliardi di configurazioni in cui le cellule possono dar luogo alla cinematica della replicazione, permettendo, così, l’individuazione della forma ideale in grado di consentire l’auto-replicazione degli xenobot (Fig. 5).

Applicazioni degli xenobot
Ad oggi gli xenobot, per quanto affascinanti, rimangono una scoperta che non possiede un’applicazione pratica. Infatti, dalla loro scoperta, essi sono stati utilizzati soprattutto come strumento scientifico utile a comprendere come le cellule cooperano tra loro per costruire corpi complessi durante la morfogenesi.
Tuttavia, secondo gli autori dell’invenzione, gli sviluppi di questa tecnologia potrebbero essere molteplici: dalla raccolta di microplastiche nell’oceano alla medicina rigenerativa.
Ad esempio, la biodegradabilità degli xenobot unitamente alla dimostrata capacità di radunare carichi microscopici in pile ordinate (Fig. 3), hanno fatto pensare a un loro utilizzo nella rimozione delle microplastiche dai corpi d’acqua. Infatti, gli xenobot potrebbero realizzare, a partire da frammenti di plastica microscopici, degli aggregati di dimensioni maggiori, più facilmente rilevabili e rimuovibili.
Un’altra ipotesi vede gli xenobot usati in future applicazioni mediche, come la consegna mirata di un farmaco all’interno del corpo umano. In particolare, in linea di principio, gli xenobot potrebbero essere realizzati con cellule staminali del paziente stesso, al fine di evitare i problemi di risposta immunologica scatenati, invece, da sistemi simili basati sull’uso di micro-robot o da altre tipologie di cellule.
Infine, simili xenobot potrebbero trovare applicazione per la rimozione di placche dalle arterie o, con l’aggiunta di altri tipi cellulari e di un’ulteriore bio-ingegnerizzazione, per la localizzazione di tumori.
Nicola Di Fidio
Sitografia:
- Sandro Marco Incerti (7 dicembre 2021, AI4BUSINESS). Xenobot, i primi “robot viventi” in grado di riprodursi. Estrapolato da: https://www.ai4business.it/intelligenza-artificiale/xenobot-i-primi-robot-viventi-in-grado-di-riprodursi/
- Viola Rita (1 dicembre 2021, WIRED). Sono stati creati i primi “robot viventi” in grado di riprodursi da soli. Estrapolato da: https://www.wired.it/article/robot-viventi-xenobot-cellule-laboratorio/
- Redazione (15 gennaio 2020, Le Scienze). Ecco gli xenobot, i primi robot fatti di cellule viventi. Estrapolato da: https://www.lescienze.it/news/2020/01/15/news/robot_viventi-4659662/
- Maria Laura Luprano (13 agosto 2016, Microbiologia Italia). Un micro-robot che simula il movimento batterico: uno sguardo al futuro della medicina. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/un-micro-robot-simula-movimento-batterico-uno-sguardo-al-futuro-della-medicina/
- Nicola Di Fidio (10 aprile 2019, Microbiologia Italia). Dalla biologia sintetica una cellula in grado di effettuare la fotosintesi. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/dalla-biologia-sintetica-una-cellula-in-grado-di-effettuare-la-fotosintesi/
- Serena Galié (9 aprile 2019, Microbiologia Italia). Caulobacter ethensis 2.0: la sfida della biologia sintetica continua. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/caulobacter-ethensis-2-0-la-sfida-della-biologia-sintetica-continua/
- Nicola Di Fidio (20 dicembre 2017, Microbiologia Italia). Dalla biologia sintetica le forme di vita del futuro. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/dalla-biologia-sintetica-le-forme-di-vita-del-futuro/
- Nicola Di Fidio (23 maggio 2018, Microbiologia Italia). Un’innovativa tecnica laser per il modellamento cellulare. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/uninnovativa-tecnica-laser-per-il-modellamento-cellulare/
Bibliografia:
- Kriegman, S., Blackiston, D., Levin, M., & Bongard, J. (2021). Kinematic self-replication in reconfigurable organisms. Proceedings of the National Academy of Sciences, 118(49).
- Blackiston, D., Lederer, E., Kriegman, S., Garnier, S., Bongard, J., & Levin, M. (2021). A cellular platform for the development of synthetic living machines. Science Robotics, 6(52), eabf1571.
- (2020). A scalable pipeline for designing reconfigurable organisms. Proceedings of the National Academy of Sciences, 117(4), 1853-1859.
- Coghlan, S., & Leins, K. (2020). “Living Robots”: Ethical Questions About Xenobots. The American Journal of Bioethics, 20(5), W1-W3.
Crediti immagini:
- Immagine in evidenza – https://it.wikipedia.org/wiki/Xenobot#/media/File:A_xenobot_in_simulation_and_reality.png
- Fig. 1,4 – https://www.ai4business.it/intelligenza-artificiale/xenobot-i-primi-robot-viventi-in-grado-di-riprodursi/
- Fig. 2 – https://it.wikipedia.org/wiki/Xenopus_laevis#/media/File:Gemeiner_Krallenfrosch_-_Xenopus_laevis_-_aus_Afrika.JPG
- Fig. 3 – https://www.hdblog.it/tecnologia/articoli/n547859/xenobot-riproduzione-autonoma-staminali/
- Fig. 5 – https://www.tio.ch/newsblog/avanti/1417170/xenobot-robot-universita-cellule-scienziati
magnifico ed inquietante ed inimmaginabile