Il termine “Cromatografia” deriva dal greco χρῶμα (colore) e deve il suo nome alla prima utilizzazione effettuata dal biochimico Michail Semënovič Cvet, il quale, riuscì a separare la clorofilla da un estratto vegetale. La cromatografia è diventata un’importante tecnica biofisica che consente la separazione, l’identificazione e la purificazione dei componenti di una miscela per analisi qualitative e quantitative.
Principio base
La cromatografia si basa sul principio secondo il quale molecole presenti all’interno di una miscela e adese ad una fase stazionaria (solida o fluida), si separano le une dalle altre mediante l’ausilio di una fase mobile. Le sostanze da separare devono potersi sciogliere completamente nella fase mobile e devono inoltre avere la capacità di interagire con la fase stazionaria. Quest’ultima è una sostanza chimica che è considerata virtualmente “immobile” mentre la fase mobile è un’altra sostanza generalmente liquida o gassosa che “scorre” sulla fase stazionaria trascinando con sé, in maniera differente, gli analiti di una miscela. In particolare, più una sostanza tende ad interagire con la fase stazionaria più rimane legata ad essa e, di conseguenza, tenderà a muoversi più lentamente insieme alla fase mobile, che nel frattempo continua a fluire regolarmente.
In base al tipo di supporto utilizzato, si distinguono differenti tecniche cromatografiche:
- Cromatografia in colonna;
- Cromatografia su strato sottile;
- Cromatografia su carta.
Cromatografia in colonna
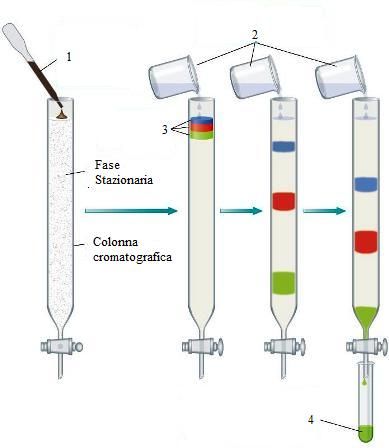
È la metodica più adatta per la separazione delle proteine e sfrutta differenze di carica, dimensione, forma, affinità di legame ed altre proprietà (Fig. 1).
Un tubo di vetro (colonna) viene riempito di un materiale poroso dotato di opportune caratteristiche chimiche (fase stazionaria) e viene fatto percolare, al suo interno, un liquido organico a bassa viscosità (fase mobile). Quest’ultimo, nel momento in cui fuoriesce dal fondo della colonna (effluente), viene rimpiazzato da una soluzione di riserva presente all’interno di un contenitore posto in cima alla colonna.
La frazione proteica, disciolta all’interno della fase mobile, viene stratificata sulla sommità della colonna cromatografica e fatta percolare all’interno della fase mobile formando così una banda il cui spessore iniziale dipende dal volume della soluzione proteica caricata. Le proteine quindi, migrando attraverso la colonna, vengono “rallentate” in maniera diversa a seconda del grado di interazione di ognuna di esse con la fase stazionaria, separandosi le une dalle altre, e formando bande discrete all’interno della banda più ampia comprendente l’intera gamma delle proteine. Alla fine della corsa, i componenti della miscela si accumulano sul fondo del dispositivo in modo dipendente dal tempo e dal volume.
La risoluzione aumenta, e quindi la separazione migliora, se si aumenta la lunghezza della colonna cromatografica. Tuttavia, anche le singole bande si allargano con il tempo per effetto della diffusione delle molecole e ciò determina una diminuzione della risoluzione stessa.
Il principio: la distribuzione degli analiti nelle due fasi
Indicando con Cm e Cs rispettivamente le concentrazioni nella fase mobile e nella fase stazionaria per ogni analita, e supponendo che le condizioni siano tali da favorire un raggiungimento dell’equilibrio per le due concentrazioni, si può rappresentare con K la costante di equilibrio implicata nella seguente relazione.
K= Cs/Cm
K è il coefficiente di ripartizione ed esprime il rapporto tra le concentrazioni dell’analita nelle due fasi a contatto fra loro. Dal valore di K dipende il tempo di ritenzione ovvero il tempo necessario alla sostanza a percorrere l’intera fase stazionaria. Ad esempio, un’elevata concentrazione nella fase stazionaria rispetto a quella nella fase mobile, indica una maggiore affinità per la prima.
Cromatografia su strato sottile (TLC)
La cromatografia su strato sottile è una tecnica utilizzata per la separazione rapida degli analiti di una miscela ed è utilizzata soprattutto per analisi di tipo qualitativo. Si tratta di una cromatografia ad “adsorbimento solido-liquido” in cui la fase stazionaria è solida (gel di silice, allumina o cellulosa in polvere) ed è fatta aderire su un apposito supporto costituito a sua volta da lastre di vetro, fogli di alluminio o carta plastificata.
Al contrario della cromatografia su colonna, dove il solvente scende per gravità, nella TLC la fase mobile viaggia verso l’alto attraverso la fase stazionaria. In particolare, la miscela contenente gli analiti da separare risale la lastra sottile imbevuta di solvente per azione capillare. Poiché la superficie della fase stazionaria è altamente irregolare, il singolo analita della miscela si lega in corrispondenza dei siti di legame attraverso interazioni dipolo-dipolo, ione-dipolo o legame idrogeno. L’analita specifico e la fase mobile competono, quindi, per i siti di binding della fase stazionaria e in base alla differente affinità dei componenti con la fase stazionaria, questi si separano in maniera differente sulla lastrina.
Visualizzazione degli analiti
Nel caso di soluti colorati, le corrispondenti “macchie” possono essere osservate direttamente ad occhio nudo. Nel caso di composti incolori è necessario utilizzare metodi specifici per la loro rivelazione come, ad esempio, la radiazione ultravioletta. Se le sostanze sono invece dotate di una propria fluorescenza, possono essere visualizzate direttamente alla luce UV. In alternativa, le sostanze che assorbono la radiazione UV ma non sono fluorescenti, appaiono come macchie scure su fondo chiaro.
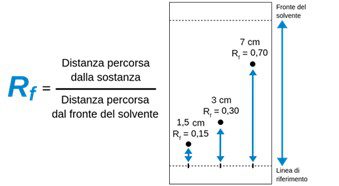
La posizione (Fig. 2) di ciascun analita nella miscela può essere misurata calcolando sia il rapporto frontale ovvero il rapporto tra la distanza percorsa dall’analita e quella percorsa dal solvente (Rf) sia la distanza tra l’origine ed il centro della macchia.
Cromatografia su carta (PC)
Si tratta di una tecnica cromatografica “liquido -liquido” il cui materiale di supporto è costituito da uno strato di cellulosa altamente saturo di acqua. Più precisamente, all’interno della carta da filtro, le gocce d’acqua si depositano nei pori che costituiscono la fase stazionaria (liquida). La striscia di carta è immersa in un becher nel quale è inserito un solvente (fase mobile). Nel momento in cui si deposita il campione sul foglio, è importante assicurarsi che il livello raggiunto dalla fase mobile sia inferiore rispetto al punto di caricamento della miscela da separare. Per capillarità, quindi, la fase mobile tende a risalire lungo il foglio di carta trascinando con sé gli analiti presenti all’interno del campione i quali, a seconda della loro affinità con la fase stazionaria, si muoveranno con differenti velocità (Fig. 3).
Anche in questo caso, si creano delle macchie differenti ognuna delle quali rappresenta la singola frazione della miscela caricata. Tali macchie, se incolori, possono essere visualizzate mediante l’uso di reattivi capaci di convertirle in composti colorati o alternativamente, se dotate di fluorescenza, possono essere visualizzate ai raggi ultravioletti (UV).

Fonti
- NCI_3_2_156_160.pdf (journalagent.com)
- Presentazione standard di PowerPoint (unifi.it)
- https://e-l.unifi.it/pluginfile.php/931227/mod_resource/content/1/Lezione%2017%20La%20Cromatografia%202019-20.pdf
Fonti immagini
- Immagine in evidenza: https://www.skuola.net/news_foto/2018/cromatografia-carta-definizione.JPG
- Figura 1 – Column chromatography definition principles procedure and theory – Artofit
- Figura 2 – Retardation_factor.it_IT.x512.png (511×280) (labster-image-manager.s3.amazonaws.com)
- Figura 3 – What Is Paper Chromatography and How Does It Work? – Owlcation