Il processo della fagocitosi
Per fagocitosi si intende, in senso stretto, un processo di endocitosi che porta all’internalizzazione di particelle con un diametro uguale o superiore a 0,3 μm. Intesa in senso lato, la fagocitosi comporta anche le fasi successive di uccisione e digestione della particella ingerita. Il significato funzionale della fagocitosi è quello di distruggere i microrganismi e di eliminare le cellule apoptosiche dell’organismo. In condizioni normali, 500 miliardi di cellule vanno ogni giorno incontro ad apoptosi (o morte cellulare programmata) durante processi di ricambio degli epiteli, di rimodellamento tissutale o di senescenza.
È fondamentale che queste cellule siano rimosse prima che vadano incontro a necrosi secondaria, cioè a un processo associato a perdita dell’integrità della membrana cellulare e allo stravaso di contenuti citoplasmatici a forte attività proinfiammatoria nello spazio extracellulare. Tutte le cellule del corpo, comprese le cellule epiteliali e i fibroblasti, sono in grado di internalizzare microrganismi e altre particelle in processi di fagocitosi. Solo alcuni tipi cellulari, i fagociti professionali, sono tuttavia in grado di compiere questi processi con rapidità, ingerendo diverse particelle al minuto, e digerendole efficientemente. I fagociti professionali comprendono alcuni leucociti del sangue (granulociti polimorfonucleati neutrofili, eosinofili, basofili e monociti), i macrofagi e le cellule dendritiche immature che sono normalmente presenti nei tessuti.
Fagociti polimorfonucleati
I macrofagi e le cellule dendritiche mieloidi derivano da monociti che vanno incontro a un processo di differenziazione nei tessuti dopo aver lasciato il sangue. I monociti, i macrofagi e le cellule dendritiche immature vengono definiti fagociti mononucleati per distinguerli dai fagociti polimorfonucleati. Questi ultimi comprendono i granulociti eosinofili, basofili e neutrofili. Dal punto di vista delle difese antibatteriche, i neutrofili sono funzionalmente più importanti degli altri granulociti. Un processo correlato alla fagocitosi, definito autofagia, comporta la digestione, da parte della cellula, di una porzione dei propri contenuti citoplasmatici.
Il significato di questo processo è quello di rimuovere organelli o parti di citosol danneggiati e di promuovere il ricambio dei contenuti cellulari. L’autofagia ha un ruolo importante anche nell’immunità innata in quanto promuove la digestione di porzioni di citoplasma contenenti microrganismi. Durante l’autofagia porzioni di citoplasma sono sequestrate in un caratteristico vacuolo a doppia membrana (definito autofagosoma) e digerite in seguito a fusione con lisosomi. L’autofagia sta emergendo come un fenomeno importante nel mediare l’uccisione di patogeni intracellulari quale Mycobacterium tuberculosis.
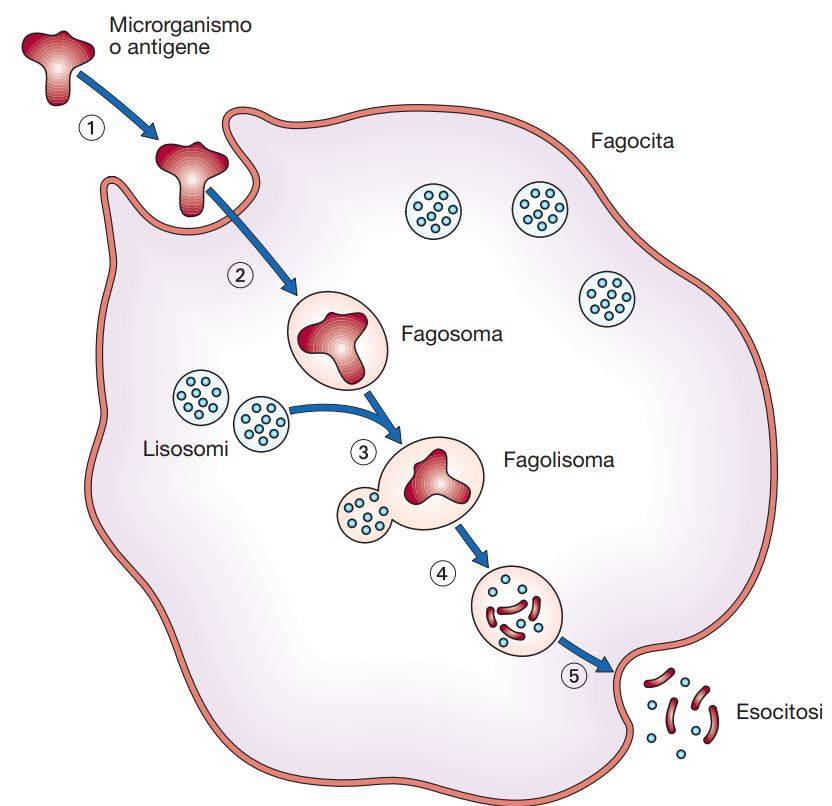
Aspetti generali della fagocitosi
I fagociti vengono prodotti nel midollo osseo, passano nel sangue e, di qui, ai tessuti, nei quali possono spostarsi mediante movimenti ameboidi. Presentano varie forme di inclusioni granulari (lisosomi) contenenti sostanze battericide ed enzimi litici, quali lisozima, proteine cationiche, proteasi, fosfatasi, nucleasi e lipasi. I neutrofili sono ricchi di lisosomi preformati (granuli), mentre i macrofagi hanno pochi granuli, che tuttavia sono in grado di sintetizzare rapidamente all’occorrenza.
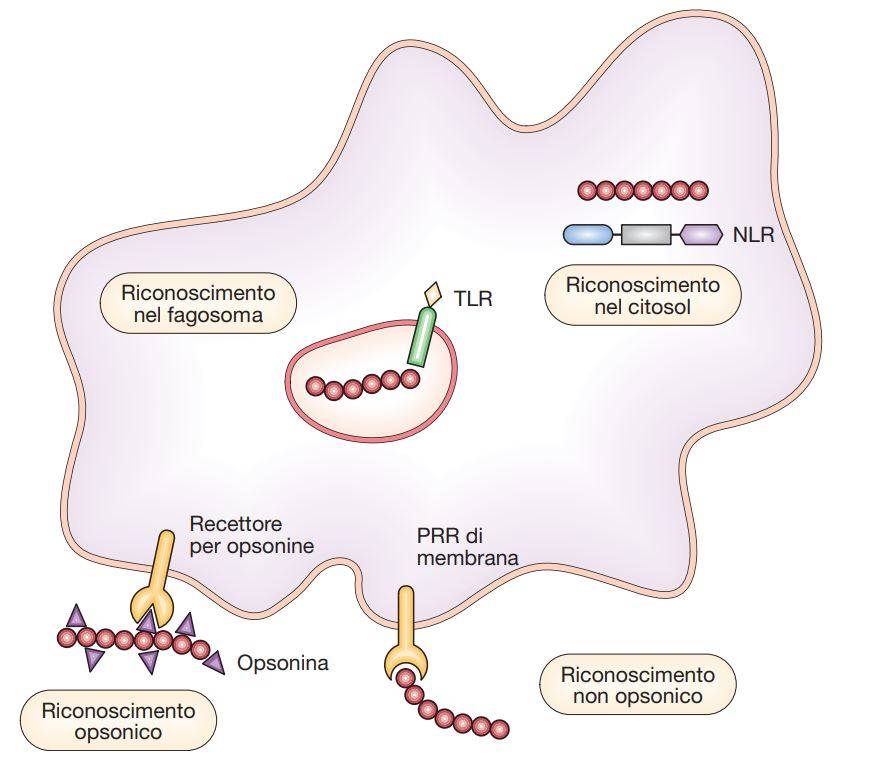
I fagociti vengono attratti nei tessuti da stimoli chimici (chemiotassi positiva), rappresentati da prodotti batterici (ad es. peptidi formilati) o mediatori prodotti dal sistema di difesa dell’ospite. Tra questi sono comprese diverse citochine proinfiammatorie, chemochine (citochine ricche di cisteina dotate di forte attività chemiotattica) e fattori del complemento (soprattutto C5a). Queste sostanze fanno sì che i fagociti lascino il sangue e si dirigano verso il focolaio infiammatorio, venendo a contatto con i microrganismi. I fagociti possono aderire ai microrganismi mediante un’interazione diretta dei propri PRR di membrana con i rispettivi PAMP microbici (fagocitosi non opsonici) oppure per l’intermediazione di opsonine e cioè di PRR solubili o di immunoglobuline.
Il ruolo delle opsonine nella fagocitosi
Le opsonine ricoprono il patogeno rendendolo “più appetibile” da parte del macrofago. Il termine “opsonina” deriva dal greco “opsao”, preparare o condire. Le opsonine funzionano da ponte, legandosi da una parte al microrganismo e dall’altra al fagocita tramite specifici recettori posti sulla superficie di questi ultimi. Tra le opsonine hanno un ruolo preminente le immunoglobuline (che non sono PRR, ma molecole di ricognizione dell’immunità adattativa) e i prodotti dell’attivazione del complemento. L’occupazione di recettori non-opsonici od opsonici (esempi di questo secondo tipo sono i recettori per la porzione Fc di IgG o FcγR e i recettori per il complemento o CR) induce la fagocitosi attraverso un processo che comporta l’aggregazione dei recettori in fasci (crosslinking) sul piano della membrana.
Fagosoma e fagolisosoma
Questa aggregazione è determinata dal fatto che la particella si comporta come un ligando multivalente. L’ingestione è preceduta dalla riorganizzazione del citoscheletro al di sotto della membrana con polimerizzazione dell’actina ad opera di GTPasi della famiglia Rho. Il risultato di questa riorganizzazione è la formazione di una sorta di coppa che avvolge la base della particella da fagocitare. Ai bordi di questa si accrescono rapidamente degli pseudopodi (le pareti della coppa) fino a ricongiungersi al di sopra della particella. Ciò porta alla chiusura di un vacuolo neoformato contenente il microrganismo (fagosoma) e, successivamente, al suo spostamento verso l’interno della cellula.
Il fagosoma va quindi incontro a diversi cicli di fissione e fusione con altri organelli, tra i quali endosomi che si formano normalmente nella cellula per un processo di endocitosi spontanea. In questo processo definito “maturazione” il fagosoma acquisisce proteine presenti sulle membrane di endosomi spontanei o di porzioni del complesso Golgi-reticolo endoplasmatico. I fagosomi si distinguono in precoci o tardivi, in base all’acquisizione di specifici marcatori di maturazione (Rab5 ed EAA1 per gli endosomi precoci; Rab7 e LAMP-1 per gli endosomi tardivi).
Durante il processo di maturazione il fagosoma si dissocia dalle proteine del citoscheletro e va incontro a una progressiva acidificazione ad opera di ATPasi vacuolari. Il fagosoma maturo si fonde con lisosomi che riversano in esso i propri contenuti per formare il fagolisosoma, ricco di sostanze microbicide e di idrolisi acide. Il processo di acidificazione, iniziato nell’endosoma, continua nel fagolisosoma. Il meccanismo generale di formazione di fagosomi e fagolisosomi è comune a tutti i tipi di fagociti (polimorfonucleati e fagociti mononucleati). Le sostanze contenute nel fagolisosoma sono più che sufficienti per l’uccisione di qualsiasi microrganismo, a meno che questo non riesca a sovvertire il funzionamento del fagocita.
Killing
L’uccisione dei microrganismi ingeriti può essere opera della semplice acidificazione del fagosoma. Più spesso l’uccisione avviene ad opera di una serie di sostanze presenti nel fagolisosoma classificabili come segue:
- intermedi reattivi dell’ossigeno
- intermedi reattivi dell’azoto
- proteine cationiche, comprese le defensine e la proteina battericida che incrementa la permeabilità (ΒΡΙ)
- idrolisi, comprese serina proteasi e fosfolipasi
- fattori nutriprivi, cioè proteine capaci di sottrarre sostanze nutritive essenziali, quale lo ione ferrico e il triptofano.
L’ingestione del microrganismo ad opera di certi recettori (ad es. CR1 e FcγR) ma non di altri (ad es. CR3 o scavanger receptor) innesca una serie di reazioni a livello del complesso enzimatico nicotinamide adenina dinucleotide fosfato (NADPH) ossidasi, presente sulla membrana dei fagociti e nel fagolisosoma, che culminano nella produzione di intermedi reattivi dell’ossigeno (ROI).
In questo processo uno dei cinque componenti del complesso della NADPH ossidasi, il flavocitocromo b559, trasporta un singolo elettrone cedendolo a una molecola di ossigeno con formazione dell’anione superossido (O2 – ). Questo dà luogo alla formazione di prodotti tossici quali il perossido di idrogeno o acqua ossigenata (H2O2), il radicale idrossilico (OH•) e l’ossigeno singoletto. I fagociti fanno uso di queste forme tossiche dell’ossigeno per uccidere i microrganismi ingeriti.
L’attività microbicida dei ROI viene grandemente esaltata dalla mieloperossidasi che in presenza di ioni cloruro forma acido ipocloroso (il componente attivo della varechina), una sostanza a forte attività antibatterica. L’acido ipocloroso reagisce a sua volta con un’altra molecola di H2O2 per dar luogo a una seconda molecola di ossigeno singoletto. In presenza di mieloperossidasi, possono avvenire analoghe interazioni tra ROI e altri alogeni (ad es. bromuro e ioduro). Il risultato è l’ossidazione di costituenti strutturali o enzimatici essenziali per il microrganismo. In questo processo gioca un ruolo importante la perossidazione dei lipidi e di costituenti della cromatina che sono in grado a loro volta di ossidare altri prodotti microbici.
L’attivazione dei macrofagi induce inoltre (in grado diverso a seconda della specie: in misura minore nell’uomo e maggiore nei roditori) la produzione di intermedi reattivi dell’azoto (RNI) da parte dell’enzima inducibile NO (ossido nitroso) sintetasi. NO è tossico per i batteri e inibisce la replicazione virale. Esso può reagire con prodotti tossici dell’ossigeno per dar luogo a radicali a base di perossinitrato.
Esistono importanti differenze tra i fagociti mononucleati e i polimorfonucleati neutrofili. I neutrofili hanno vita breve (2-3 giorni) e, all’esame istologico, non si riscontrano in condizioni normali negli organi, con l’eccezione del sangue e del midollo osseo. I fagociti mononucleati, al contrario, vivono per diversi anni nei tessuti, e hanno un ruolo importante nel regolare il funzionamento e la differenziazione delle cellule circostanti.
Sovversione della fagocitosi da parte dei batteri
Alcuni patogeni riescono a evitare di essere ingeriti dal fagocita. Ad esempio, membri del genere Yersinia, compresa Yersinia pestis (agente della peste), usano un sistema di secrezione di tipo III per inoculare nel fagocita proteine che bloccano la polimerizzazione dell’actina, un componente del citoscheletro indispensabile per l’ingestione e quindi la formazione del fagosoma. Una strategia più frequente è l’espressione di strutture di superficie, come la capsula o la proteina M di Streptococcus pyogenes, che impediscono la deposizione di fattori opsonizzanti del complemento. Ciò avviene attraverso il legame preferenziale con componenti del complemento che ne inibiscono l’attivazione, come il fattore H. Inoltre, la capsula ricopre alcuni PAMP che sarebbero altrimenti riconoscibili da parte di PRR solubili o presenti sulla superficie del fagocita.
I patogeni dotati di capsula evadono l’internalizzazione da parte dei fagociti e possono resistere all’interno di compartimenti corporei ricchi di complemento come il sangue. Non a caso, la grande maggioranza dei batteri che infettano per via ematogena il sistema nervoso centrale e le meningi sono capsulati (ad es. Streptococcus pneumoniae, Neisseria meningitidis, Streptococcus agalactiae).
Alcuni patogeni non solo non ostacolano il processo di ingestione, ma lo utilizzano per persistere all’interno di cellule dell’ospite, macrofagi compresi. Ciò è possibile perché questi microrganismi riescono a controllare il proprio fato all’interno del fagocita, spostandosi in compartimenti favorevoli o creandone di nuovi. Esistono due strategie fondamentali: evasione da vacuoli fagocitari e replicazione all’interno di vacuoli modificati.
Esempi della prima strategia sono patogeni come Shigella spp. o Listeria spp., che “bucano” la membrana del fagosoma sfuggendo nel citosol, dove si replicano per diffondersi alle cellule vicine. Più spesso i patogeni intracellulari persistono in vari tipi di vacuoli modificati racchiusi da membrana. È il caso di membri dei generi Mycobacterium, Salmonella, Chlamydia, Brucella, Leishmania e Toxoplasma. Queste specie adottano differenti strategie per generare un ambiente favorevole alla replicazione, come indicato dalle diverse caratteristiche dei vacuoli che ospitano i patogeni.
Ad esempio, i micobatteri impediscono l’acidificazione del fagosoma, che non può quindi interagire con endosomi tardivi o con lisosomi. Pertanto, i vacuoli che ospitano micobatteri contengono marker tipici degli endosomi precoci. I vacuoli contenenti Salmonella, al contrario, presentano marker di endosomi tardivi. Altri patogeni ancora, come Chlamydia spp., intercettano delle vescicole esocitosiche prima che queste riversino all’esterno i propri contenuti secretori; la fusione con queste vescicole è testimoniata dalla presenza di lipidi della rete trans-Golgi nei vacuoli che ospitano Chlamydia. Infine Toxoplasma gondii, Brucella spp. e Legionella pneumophila interagiscono con il reticolo endoplasmico, un ambiente teoricamente ideale per la propria riproduzione.
L’IFN-γ riesce a sovvertire le strategie messe in atto dai patogeni intracellulari, conferendo ai macrofagi la capacità di ucciderli. Questa citochina si lega a specifici recettori presenti sul fagocita (IFNGR) inducendo un’aumentata espressione di diversi geni. I più importanti sono quelli che codificano per il complesso della NADPH ossidasi (phox), per la NO sintetasi inducibile (iNOS), per ΝRAMP1 (natural-resistance-associated-macrophage protein 1), per IDO (indoleamine 2,3-dioxygenase) e per la famiglia delle p47GTPasi. Le p47GTPasi (ne sono state identificate 6 nel topo) hanno destato molto interesse in quanto regolano la maturazione del fagosoma e la fusione dei lisosomi con i fagosomi. Queste funzioni dipendono dalla localizzazione delle varie p47GTPasi in compartimenti cellulari diversi, e dalla loro capacità di controllare il trasporto attraverso la membrana di questi vacuoli di fattori che promuovono i processi di fusione e di maturazione del fagosoma.