Il sistema nervoso rileva e interpreta un’ampia gamma di stimoli termici e meccanici, nonché irritanti chimici, ambientali ed endogeni attraverso neuroni sensoriali periferici specializzati noti come nocicettori. Questi ci avvisano di stimoli potenzialmente dannosi sulla pelle correlate a possibili lesioni (estremi di temperatura, pressione, sostanze chimiche). I nocicettori trasducono questi stimoli in segnali elettrici a lungo raggio che vengono trasmessi ai centri cerebrali superiori. L’attivazione di popolazioni di nocicettori cutanei funzionalmente distinte e l’elaborazione delle informazioni che trasmettono, forniscono una ricca diversità di qualità del dolore. Quando gli stimoli sono intensi, sia i componenti del sistema nervoso periferico che quello centrale della via di trasmissione, mostrano un’enorme plasticità. Quando la plasticità facilita i riflessi protettivi, può essere utile, ma quando i cambiamenti persistono, può verificarsi una condizione di dolore cronico. Diversi studi stanno chiarendo i meccanismi molecolari che sono alla base del rilevamento, della codifica e della modulazione degli stimoli nocivi che generano dolore. Questo sofisticato meccanismo di difesa viene finemente gestito dalle vie nocicettive e dai loro protagonisti: i nocicettori.
Il dolore
Il dolore, come sub modalità della sensazione somatica, è stato definito come una “complessa costellazione di esperienze sensoriali, emotive e cognitive spiacevoli provocate da danni tissutali reali o percepiti e manifestate da determinate reazioni autonomiche, psicologiche e comportamentali”. La capacità di rilevare stimoli nocivi è essenziale per la sopravvivenza e il benessere di un organismo.
Il dolore è descritto come avente qualità e caratteristiche temporali diverse a seconda della modalità e della località dello stimolo: il primo dolore è descritto come lancinante o pungente; il secondo dolore è più pervasivo e comprende bruciore, pulsazione, crampi e dolore e recluta componenti affettive prolungate con descrittori come “malessere”. L’intensità di queste reazioni globali sottolinea l’importanza di evitare situazioni dannose per la sopravvivenza e il mantenimento dell’omeostasi.
L’importanza del dolore
L’importanza del dolore è drammaticamente illustrata da persone con insensibilità congenita al dolore: queste non possono sentire il dolore lancinante causato da un oggetto appuntito, il calore di una fiamma libera o il disagio associato a lesioni interne, come un osso rotto. Di conseguenza, non adottano comportamenti protettivi adeguati contro queste condizioni, molte delle quali possono essere pericolose per la vita.
Più comunemente, alterazioni del percorso del dolore portano a ipersensibilità, tanto che il dolore sopravvive alla sua utilità come sistema di allarme acuto e diventa invece cronico e debilitante. Ciò può essere visto, ad un certo livello, come un’estensione del normale processo di guarigione, per cui il danno tissutale o nervoso stimola l’iperattività per promuovere la protezione dell’area lesa.
Ad esempio, le scottature solari producono una sensibilizzazione temporanea della zona interessata. Di conseguenza, stimoli normalmente innocui, come un tocco leggero o il calore, sono percepiti come dolorosi (un fenomeno denominato allodinia), oppure stimoli normalmente dolorosi provocano dolore di maggiore intensità (denominato iperalgesia).
Al suo estremo, la sensibilizzazione non si risolve. Infatti, gli individui che soffrono di artrite, nevralgia post-erpetica (dopo un attacco di fuoco di Sant’Antonio) o cancro alle ossa sperimentano un dolore intenso e spesso incessante che non solo è fisiologicamente e psicologicamente debilitante, ma può anche ostacolare il recupero. Il dolore cronico può persistere anche molto tempo dopo una lesione acuta, forse più comunemente sperimentato come mal di schiena o sciatica.
Nocicezione e dolore
La nocicezione è l’insieme dei meccanismi molecolari alla base dell’attivazione del recettore dolorifico e non va confusa con il dolore. Il dolore è la percezione cosciente del danno che, invece, può variare da individuo a individuo in base a:
- contesto ed esperienze passate;
- fattori psichici e socio-culturali;
- modulazione intrinseca dovuta a processi di inibizione
Nocicezione e nocicettori: qual è la differenza?
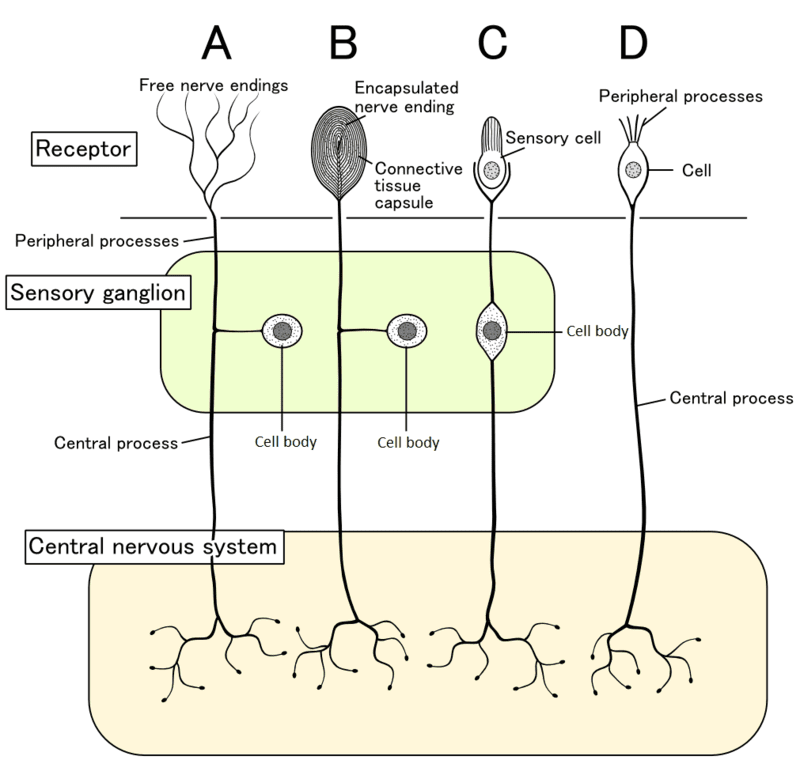
La nocicezione è il processo mediante il quale intensi stimoli termici, meccanici o chimici vengono rilevati da una sottopopolazione di fibre nervose periferiche, chiamate nocicettori. I nocicettori sono neuroni sensoriali con terminazioni nervose libere che rispondono a una varietà di stimoli che causano, o che potrebbero causare, un danno tissutale:
- stimoli chimici
- stimoli meccanici
- stimoli termici
Questi sono distribuiti in moltissime parti del corpo:
- cute
- articolazioni
- muscoli
- ossa
- vari origani interni
Molti altri organi però ne sono sprovvisti (sistema nervoso centrale, rene, fegato, milza, polmone, pleura viscerale per esempio).
L’attivazione delle vie nocicettive innesca risposte adattative di protezione: per esempio, il malessere correlato ad un uso eccessivo dei muscoli e delle articolazioni, tende a rallentare ulteriori movimenti per evitare ulteriori danni.
I due tipi di nocicettori
I nocicettori vengono eccitati solo quando l’intensità dello stimolo raggiunge il range nocivo, suggerendo che possiedono proprietà biofisiche e molecolari che consentono loro di rilevare selettivamente e rispondere a stimoli potenzialmente dannosi. I nocicettori sono classificati in base al tipo di fibra che li caratterizza e al tipo di stimolo a cui rispondono. Le fibre dolorifiche possono appartenere al gruppo delle:
- Fibre Aδ, piccole (Ø: 3-5μm), mielinizzate, conducono impulsi a velocità comprese tra 6-30 m/s, rispondono a stimoli meccanici o meccano-termici di alta intensità; mediano il dolore acuto, ben localizzato, “primo” o veloce. Queste afferenze mielinizzate differiscono notevolmente dalle fibre Aβ di diametro maggiore e a conduzione rapida che rispondono a innocue stimolazioni meccaniche (cioè tocco leggero).
- Fibre C, piccole (Ø: 0.2-1μm), amieliniche, conducono impulsi a velocità comprese tra 0.5-2 m/s, rispondono in maniera polimodale a stimoli meccanici, termici e chimici; trasmettono dolore scarsamente localizzato, “secondo” o lento.
La bi direzionalità dell’informazione
La nocicezione origina dall’attivazione di terminazioni libere e arborizzate di neuroni somatici sensoriali (neuroni di I ordine) che hanno il corpo cellulare nei gangli delle radici dorsali e proiettano un assone alla periferia e uno al midollo spinale (o bulbo). Generalmente si pensa che il nocicettore porti informazioni in una direzione, trasmettendo stimoli nocivi dalla periferia al midollo spinale. Tuttavia, le fibre afferenti primarie hanno una morfologia unica, chiamata pseudo-unipolare, in cui sia i terminali centrali che quelli periferici emanano da un peduncolo assonale comune.

Nocicettori: meccanismi molecolari
I nocicettori e trasducono segnali meccanici, termici e/o chimici in potenziali graduati di recettore. Il potenziale di recettore è convertito in scariche di potenziali d’azione nei recettori stessi (codificazione). L’informazione sarà poi trasmessa attraverso vie ascendenti specifiche costituite da neuroni di II e III ordine.
- Il dolore rapido iniziale, acuto e localizzato (ben definito spazialmente), è trasmesso in modo rapido al SNC dalle fibre Aδ, piccole e mielinizzate.
Evoca una pronta risposta comportamentale difensiva (entro 100ms). - ll dolore lento (ritardato), sordo (meno acuto) e diffuso (mal definito spazialmente), viene trasmesso dalle fibre C, ancora più piccole e amieliniche e a più lenta velocità di conduzione. Evoca risposte emozionali (dopo un secondo o più).
- Quando lo stimolo si origina in un punto lontano dal SNC, la diversa velocità di trasmissione dei due canali risulta più evidente. Per esempio, quando si urta l’alluce, prima si sente una fitta acuta (dolore rapido) e poi questa è seguita in breve tempo da una pulsazione continua (dolore lento).
- I recettori dolorifici cutanei sono caratterizzati da un’elevata densità (100/cm2) e campi recettivi comunque di piccole dimensioni. Hanno pertanto un’elevata discriminazione spaziale e questo è molto importante dal punto di vista «difensivo» per la protezione dal danno. I recettori dolorifici profondi sono caratterizzati invece da una bassa densità e campi recettivi estesi. Hanno pertanto una minima discriminazione spaziale.
Nocicettori: trasduzione
Il danno tissutale determina la liberazione o sintesi di sostanze chimiche algogene, tra le quali bradichinina e K+ (potassio). Queste sostanze sono in grado di modificare la permeabilità del neurone recettore.
La bradichinina è una sostanza normalmente inattiva che viene attivata da enzimi proteolitici rilasciati nel liquido extracellulare dal tessuto danneggiato. La bradichinina agisce su recettori di membrana della terminazione dolorifica associati a proteine G. Questa attiva una ciclasi di membrana che avvia una cascata di reazioni intracellulari che determinano a loro volta l’apertura di canali per il Ca2+ (calcio). Il Ca2+ entra per gradiente elettrochimico determinando la depolarizzazione membranale e la formazione del potenziale del recettore (trasduzione). Il K+ viene rilasciato nell’ambiente extracellulare dalle cellule che muoiono come conseguenza del danno. La concentrazione del K+ esternamente aumenta variando il rapporto tra K esterno e K + interno. Di conseguenza, esce meno K e quindi la membrana depolarizza con la formazione di un potenziale del recettore (trasduzione).
Nocicettori: codificazione
La membrana della terminazione periferica depolarizza principalmente per due motivi:
- sono entrate cariche positive, come nel caso della bradichinina
- sono uscite meno cariche positive, come nel caso del K +
Le correnti generate, determinano la formazione di una scarica di potenziali d’azione nell’encoder (codificazione) la cui frequenza è proporzionale all’ampiezza del potenziale del recettore. Questo a sua volta è proporzionale all’intensità dello stimolo e quindi:
- all’entità danno
- alla concentrazione delle molecole algogene
Sono recettori tonici quasi privi di adattamento e quindi, finché persiste il danno, si percepisce il dolore con un minimo di adattamento. Ciò significa che il danno si è ridotto leggermente.
- Questo, a sua volta, determina un aumento dell’ampiezza del potenziale del recettore (trasduzione) che determina una scarica di potenziali d’azione a maggior frequenza nell’encoder (codificazione).
- Più aumenta la durata dello stimolo, più aumenta la persistenza delle molecole algogene nell’area danneggiata.
- Questo determina un aumento della durata del potenziale del recettore (trasduzione); nell’encoder, questo provoca un aumento della durata della scarica dei potenziali d’azione (codificazione).
TRPVI: un recettore da Nobel
Il Nobel per la medicina o la fisiologia è stato assegnato nel 2021 a David Julius e Ardem Patapoutian, per la scoperta dei recettori per la temperatura e il tatto. A Julius, in particolare, va il merito di aver individuato il recettore TRPV1 sulle terminazioni nervose della pelle. La funzione di TRPV1 è il rilevamento e la regolazione della temperatura corporea. Inoltre, TRPV1 fornisce una sensazione di calore bruciante e dolore (nocicezione).
Gli scienziati giunsero a questo risultato utilizzando la capsaicina, una sostanza irritante presente nel peperoncino che provoca una sensazione di calore e bruciore nei tessuti con cui viene in contatto.
Covid-19
Dall’inizio della pandemia di COVID-19, è stato descritto che l’infezione da SARS-CoV-2 causa danni alle vie aeree, come la perdita di cellule multi ciliate e la distruzione alveolare. Gran parte del danno ai polmoni può anche essere dovuto a un’infiammazione travolgente e a una ridotta risposta antivirale, che porta a lesioni dei tessuti e disfunzioni d’organo. Le analisi su singole cellule hanno riportato una ridotta risposta agli interferoni di tipo I e una maggiore espressione di citochine e chemochine pro infiammatorie nei polmoni dei pazienti con COVID-19. Inoltre, caratteristiche neuropatologiche sono state riscontrate nelle autopsie di pazienti COVID-19 in cui sono state trovate un’infiltrazione infiammatoria e cellule immunitarie attivate in regioni specifiche del sistema nervoso centrale.
Covid-19 e nocicettori: possibile correlazione?
Ciò suggerisce che le conseguenze neurologiche potrebbero essere mediate dalla neuro infiammazione. Se questi meccanismi neuro immunopatologici si verifichino nei polmoni e le loro conseguenze rimangono senza risposta. Gli sviluppi di vari modelli hanno consentito una migliore comprensione dei meccanismi attraverso i quali SARS-CoV-2 infetta e media la patologia COVID-19, inclusa l’innervazione delle vie aeree. Gli scienziati hanno riscontrato una maggiore espressione di chemochine pro infiammatorie (ad esempio CCL e CXCL) all’interno del fluido di lavaggio bronco alveolare (BALF) del COVID-19, suggerendo una connessione tra infiammazione e attivazione dei neuroni sensoriali.

Fonti e Bibliografia:
- Dubin AE, Patapoutian A. Nociceptors: the sensors of the pain pathway. J Clin Invest. 2010 Nov;120(11):3760-72. doi: 10.1172/JCI42843. Epub 2010 Nov 1. PMID: 21041958; PMCID: PMC2964977.
- Basbaum AI, Bautista DM, Scherrer G, Julius D. Cellular and molecular mechanisms of pain. Cell. 2009 Oct 16;139(2):267-84. doi: 10.1016/j.cell.2009.09.028. PMID: 19837031; PMCID: PMC2852643.
- Hiroki CH, Sarden N, Hassanabad MF, Yipp BG. Innate Receptors Expression by Lung Nociceptors: Impact on COVID-19 and Aging. Front Immunol. 2021 Dec 16;12:785355. doi: 10.3389/fimmu.2021.785355. PMID: 34975876; PMCID: PMC8716370.
- Covid-19 e TRPV1, il recettore da Nobel | Il Bo Live UniPD
- Fisiologia umana. Un approccio integrato. Silverthorn. Pearson Italia. Settima edizione
- Nocicettore – Wikipedia
Crediti immagini:
- Figura 1: Consigli e rimedi per le scottature solari – Farmacia Croce Bianca – Bologna (farmacia-crocebianca.it)
- Figura 2: Nocicettore – Wikipedia
- Figura 3: Come alleviare il dolore muscolare con creme naturali – Sanioggi.it
- Figura 4: Basbaum AI, Bautista DM, Scherrer G, Julius D. Cellular and molecular mechanisms of pain. Cell. 2009 Oct 16;139(2):267-84. doi: 10.1016/j.cell.2009.09.028. PMID: 19837031; PMCID: PMC2852643.
- Figura 5: Hiroki CH, Sarden N, Hassanabad MF, Yipp BG. Innate Receptors Expression by Lung Nociceptors: Impact on COVID-19 and Aging. Front Immunol. 2021 Dec 16;12:785355. doi: 10.3389/fimmu.2021.785355. PMID: 34975876; PMCID: PMC8716370.