Premessa
Il corpo umano ospita un ecosistema microbico complesso e diversificato che svolge un ruolo centrale nella salute dell’ospite.
Tale ecosistema, particolarmente ricco nel tratto gastrointestinale umano (GIT), contiene una varietà di microrganismi che comprende batteri, archaea, virus e microrganismi eucarioti. Questa “biosfera rara” include anche la componente fungina meglio definita come “micobiota ” intestinale.
Sebbene la ricerca sul micobioma sia ancora agli inizi, il suo potenziale ruolo nella genesi di alcune patologie umane è sempre più riconosciuto.
Nel presente articolo si vuole fare una brevissima rassegna delle attuali conoscenze sul micobiota umano con maggiore accento su quello intestinale, esaminando anche il modo in cui i funghi interagiscono con l’ospite umano e altri microbi.
Il micobiota intestinale umano
Di recente, il micobioma intestinale umano sta ricevendo maggiore attenzione da parte della ricerca.
Questo crescente interesse è in gran parte guidato dalle recenti scoperte che funghi specifici possono modulare la risposta immunitaria dell’ospite e di conseguenza rappresentare un fattore di rischio nei disordini immunologici in individui geneticamente suscettibili. C’è anche una sempre maggiore evidenza del fatto che il micobioma possa fungere da serbatoio per agenti patogeni potenzialmente opportunisti nei soggetti immuno-compromessi e che possa svolgere un ruolo in molte malattie che non sono direttamente correlate all’intestino.
Riguardo ai potenziali benefici per la salute o sugli effetti probiotici di alcune specie fungine, si hanno maggiori conoscenze anche se, comunque, vanno esplorate più a fondo.
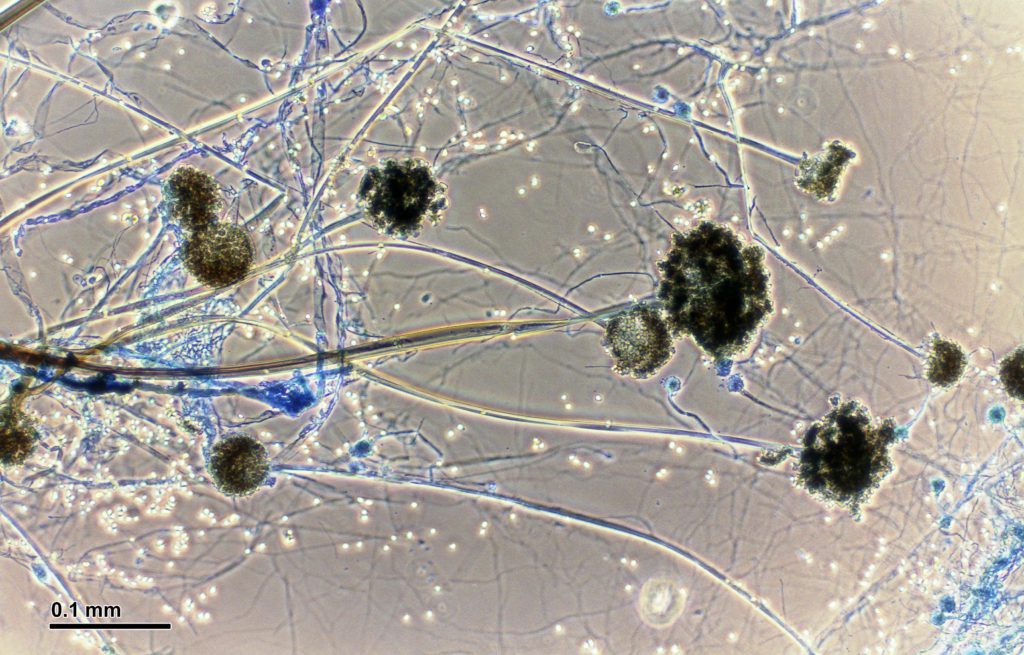
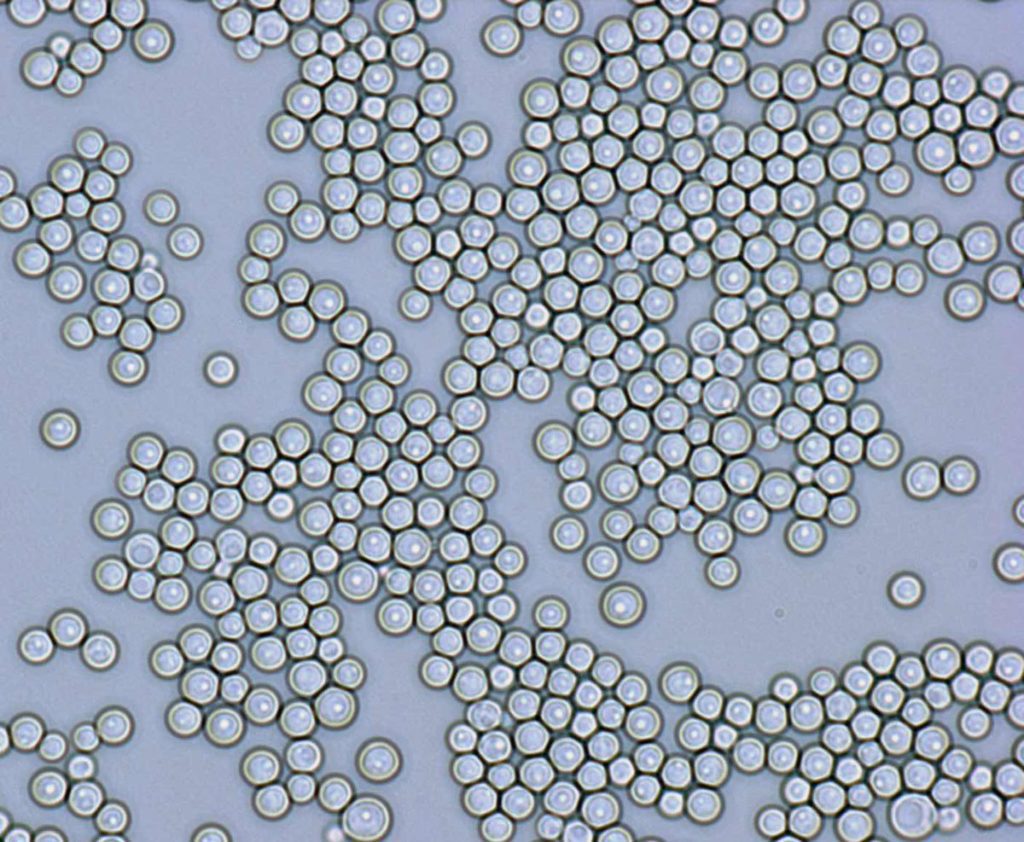
Analogamente a quanto riscontrato con i batteri componenti il microbiota intestinale, anche i funghi facenti parte del micobiota hanno evidenziato una certa refrattarietà alla crescita sui terreni di coltura convenzionali.
Pertanto, per lo studio di alcune specie, difficilmente coltivabili, oltre che utilizzare i metodi convenzionali (microscopici, colturali, biochimici) si applicano tecnologie moderne non convenzionali quali, per esempio, la PCR, la NGS.
Gli studi attuali hanno consentito di comprendere la relazione tra i funghi e varie patologie quali l’obesità, la sindrome dell’intestino permeabile (IBS), il diabete, i disordini alimentari, ecc.
Sebbene comunemente si crede che le specie Candida sia quella predominante, specie nel tratto gastrointestinale, nell’intestino stesso è stata rilevata una ricchezza di altre specie fungine utilizzando i cosiddetti metodi convenzionali con l’utilizzo di terreni per miceti quali il BHI, il terreno Czapek-Dox, il Malt-extract agar, il YPD-agar (estratto di lievito-bacto peptone-glucosio agar), il CHROM-agar Candida.

Studi sul micobiota intestinale umano
Uno dei primi studi che ha studiato la prevalenza e diversità dei microrganismi eucarioti nell’intestino umano sano è stato pubblicato nel 2008 utilizzando una combinazione di metodi convenzionali e non convenzionali.
Tra i soggetti studiati l’intestino dei neonati è stato l’obiettivo della ricerca sui micobioti e uno studio relativamente recente ha dimostrato che i funghi sono presenti nel tratto gastrointestinale del neonato originando dall’ambiente vaginale materno ed esclusivamente nei neonati allattati al seno.
La diversità delle specie è risultata piuttosto variabile tra i neonati; tuttavia, tutti i bambini erano positivi per la presenza di Candida albicans e i funghi prevalenti trovati sono stati C. albicans, Leptosphaerulina e C. parapsilosis.
Uno studio recente ha dimostrato che l’età e il sesso influenzano la composizione del micobiota intestinale; la ricchezza di specie del micobiota intestinale risulta maggiore nei neonati e nei bambini rispetto ai soggetti adulti.
Altri studiosi, indagando il tratto intestinale di soggetti adulti sani, hanno segnalato la predominanza di Penicillium, Aspergillus e Candida, esattamente come rilevato anche in altri studi.
È stato anche studiato l’effetto del genere sul micobiota e si è trovato un effetto significativo sul micobiota in soggetti di sesso femminile che mostrano un numero maggiore di specie segnalate rispetto ai maschi.
Micobiota intestinale e patologie nell’uomo
In uno studio che ha esaminato l’impatto del micobiota in neonati (di 1 mese di età) sullo sviluppo dell’asma durante l’infanzia (6 mesi), è stato osservato che la diversità batterica era inversamente correlata con la diversità fungina.
Una diminuzione dei taxa fungini Malassezia e un aumento di Rhodotorula e Candida, correlato con un numero ridotto di taxa batterici, è stato associato ad un rischio più elevato di sviluppo dell’asma allergica infantile.
Questi risultati hanno portato gli autori a suggerire una coevoluzione di interregni nel primo anno di vita; però, ulteriori ricerche che prevedano un’analisi temporale di neonati fino all’età adulta sono necessarie per determinare se il micobioma fungino subisce un cambiamento drammatico equivalente a quello osservato per i microbioti batterici e virali nei primi anni di vita.
Più recentemente è stato studiato il rapporto tra dieta e micobiota in individui sani analizzando campioni provenienti da 96 individui. Lo studio ha anche scoperto che i funghi più diffusi nell’intestino provenivano dal genere Saccharomyces, che è stato rilevato in 89% dei campioni.
Gli autori hanno ipotizzato che l’alto livello di Saccharomyces potrebbe essere dovuto all’ingestione di lievito contenente cibi come pane e birra. Oltre Saccharomyces, le specie di Candida erano presenti nel 57% dei campioni, seguito da Cladosporium, che è stato rilevato nel 42% dei campioni.
Negli ultimi anni, numerosi studi hanno dimostrato che esiste una relazione forte tra microbiota intestinale ed obesità; però, tutti gli studi condotti, si sono focalizzati solo sul ruolo eziopatologico dei batteri intestinali. In effetti, si è proceduti alla caratterizzazione del microbiota batterico nei soggetti magri e in quelli obesi, ignorando il potenziale contributo fornito sulla salute metabolica dai funghi o da altre tipologie microbiche non batteriche.
I funghi hanno recentemente dimostrato, in più sperimentazioni, di essere in grado di sostenere una condizione infiammatoria a livello intestinale.
Questi organismi, anche se rappresentano una piccola componente del microbiota, sono molto importanti in quanto svolgono un ruolo critici nel mantenimento della funzione del microbiota intestinale.
Di conseguenza per poter comprendere bene la relazione microbiota-obesità occorre tenere in considerazione tutte le tipologie di microrganismi presenti nel tratto gastro-intestinale, le loro interazioni intra ed inter specifiche nonché i rapporti con le cellule dell’ospite.
In una sperimentazione, un gruppo di topi alimentati con una dieta ad alto contenuto lipidico mostrava abbondanze significativamente diverse in 19 tipologie batteriche e 6 fungine rispetto al gruppo di topi alimentati con una dieta standard. Rispetto a quanto ci si aspettasse, la biodiversità del microbiota intestinale risultava significativamente ridotta nelle diete ad alto contenuto lipidico rispetto alle diete standard.
I ricercatori hanno anche identificato correlazioni di coabbondanza tra specie fungine e batteriche nei topi alimentati attraverso una dieta standard e hanno scoperto che il numero di queste correlazioni diminuiva nei topi sottoposta ad una “high fat diet”.
In contrasto con molti altri studi sul micobiota umano, uno studio ha rilevato che Penicillium, presente nel 73% dei campioni, era il più diffuso genere fungino, seguito da Candida, Saccharomyces, Mucor e Aspergillus rispettivamente al 55%, 55%, 38% e 35%.
I generi più abbondanti negli obesi erano Candida, Nakaseomyces e Penicillium, mentre Mucor, Candida e Penicillium erano i generi più abbondanti nel gruppo di controllo.
Inoltre, è stato osservato che i generi Mucor e Penicillium erano correlati negativamente con BMI, massa grassa, massa grassa androide e circonferenza dell’anca, mentre il genere Aspergillus era positivamente associata all’adiposità.
La correlazione tra Mucor spp. e la magrezza è stata studiata prima e dopo la perdita di peso indotta da cambiamenti dietetici ed è stato osservato che l’abbondanza relativa di Mucor spp. correla con il grado di perdita di peso. Tuttavia, sono necessari ulteriori dati per determinare se i cambiamenti in Mucor spp. l’abbondanza contribuisce a perdere peso o se è una conseguenza.
Gli effetti delle micotossine prodotte da Debaryomyces hansenii sulla Candida hanno portato al suggerimento che D. hansenii potrebbe avere un impatto rilevante sulle popolazioni di Candida nell’intestino.
Questo è analogo al razionale dell’utilizzo di molte specie di batteri come probiotici per mitigare gli effetti potenzialmente dannosi di specifici microbi intestinali sulla salute dell’ospite.
Di conseguenza, ciò che emerge è che non solo la comunità fungina risente dei cambiamenti dietetici ma che gli stessi siano in grado di modificare anche le relazioni inter-specifiche funghi-batteri.
Ciò dimostra, se ce ne fosse ancora la necessità, che i Regni microbici intestinali non sono isolati ma perfettamente interagenti e modificandone la struttura di uno si hanno ripercussioni (anche profonde) sugli altri.
Inoltre, ulteriori ricerche potrebbero permettere l’utilizzo di interventi dietetici che includano l’integrazione nella dieta dell’ospite di alimenti con presunti effetti antifungini al fine di modulare selettivamente il profilo fungino con l’obiettivo ultimo di influenzare la salute dell’ospite. Allo stesso modo, l’uso di specifici microrganismi che possono inibire la crescita delle specie di funghi indesiderati possono rivelarsi un’altra utile strategia di intervento.
Il micobioma umano è stato collegato a una pletora di malattie intestinali tra cui IBD, adenomi colon rettali, adenoma pancreatico duttale, pouchite a seguito di anastomosi anale della sacca ileale, diarrea e allotrapianti intestinali, rendendolo così un fattore chiave per influenzare la salute stato dell’ospite.
Uno studio mostra che il micobiota di volontari sani differisce da quello dei pazienti con IBS e che tra i pazienti con IBS, quelli con ipersensibilità viscerale mostrano una “impronta fungina” specifica.
Diversi studi hanno dimostrato che la struttura della comunità batterica è alterata negli individui con IBD (inflammatory bowel disease) rispetto ai controlli con una perdita della diversità delle specie anaerobiche che può avere un profondo effetto sulla infiammazione della mucosa nelle IBD.
Più recentemente, studi di coorte su modelli murini e umani, compresi i neonati, indicano che la presenza di alcune specie fungine specifiche è alterata nelle IBD rispetto ai controlli.
Uno studio più recente su 235 pazienti con IBD e 35 sani controlli, hanno anche riscontrato differenze tra il micobioma di questi due gruppi. Sebbene le differenze all’interno del gruppo delle IBD (che comprendeva pazienti con colite ulcerosa e malattia di Crohn) con casi di remissione e di ricaduta fossero evidenti, i risultati hanno evidenziato un aumento del rapporto Basidiomycota/Ascomycota, insieme ad una maggiore proporzione di C. albicans e Malassezia sympodialis e una ridotta percentuale di Saccharomyces cerevisiae rispetto ai controlli sani.
Significative sono state le differenze tra remissione e ricaduta all’interno della coorte IBD. Ad esempio, C. albicans era significativamente aumentata di numero durante la ricaduta rispetto alla remissione.
È interessante notare che la diversità fungina è stata ridotta solo nella malattia di Crohn (CD). Questa scoperta si è unita all’analisi batterica dei campioni ha portato gli autori a suggerire che l’ambiente intestinale specifico degli individui con malattia di CD può favorire i funghi a spese di batteri.
Il sottogruppo con colite ulcerosa (CU) più grave risultava arricchito per le specie C. albicans e Debaryomyces come così come il genere batterico Bacteroides. Questo aumento dell’ordine dei funghi Saccharomycetales è stato segnalato in un certo numero di studi precedenti sull’IBD.
Conclusioni
Sebbene dagli studi sui micobiomi intestinali eseguiti fino ad oggi sia stato segnalato un repertorio diversificato di specie fungine, la stragrande maggioranza sono rappresentati da due phyla, cioè Basidiomycota e Ascomycota, oltre a un numero minore di generi di Zygomycota.
Attualmente, non è chiaro se i cambiamenti nel micobioma osservati in molte malattie sono una conseguenza della malattia o se, in effetti, svolgono un ruolo nell’eziologia della malattia stessa. Un esempio di ciò è la segnalazione dei generi Candida, Aspergillus, Penicillium e Debaryomyces, che si trovano nel micobioma intestinale sano ma che sono spesso segnalate in casi di malattia e perturbazione gastrointestinale.
Questi dati contraddittori possono riflettere differenze di specie o di ceppi nella composizione fungina correlate a fattori genetici dell’ospite o a differenze individuali degli altri componenti del microbioma.
Inoltre, molte delle specie fungine rilevate nell’intestino si è ipotizzato che possano essere di origine alimentare e quindi rappresentare solo una componente transitoria della comunità microbica.
È anche evidente che diverse metodologie di indagine possono dare risultati differenti e quindi è chiaro che debbano essere effettuati più studi che utilizzano metodi convenzionali e non condotti su grandi coorti di individui che, idealmente, dovrebbero provenire da diverse regioni geografiche e da differenti condizioni di salute per consentire di definire punti in comune e differenze tra gruppi e individui, valutare se esiste un “core micobiota” e riuscire ad apprezzare appieno il ruolo del micobiota nella salute e nella malattia.
Lo studio per caratterizzare il micobiota in termini di specie è solo all’inizio e comprendere la funzionalità delle varie specie fungine compreso il modo in cui esse interagiscono con gli altri eucarioti e procarioti presenti nell’intestino e, soprattutto, come queste interazioni influenzano, i loro ospiti umani resta da chiarire.
I risultati degli studi sostengono, quindi, la necessità di includere anche il Regno dei funghi negli studi che cercano di scoprire nuovi collegamenti tra i vari microbioti intestinali e la salute.
Giuseppe Chindemi
Fonti
- Gunsalus K.T., Tornberg-Belanger S.N., Matthan N.R. et al. “Manipulation of host diet to reduce gastrointestinal colonization by the opportunistic pathogen Candida albicans”. mSphere 2016; 1: e00020–15.
- Huseyin C.E., O’Toole P.W., Cotter P.D., Scanlan P.D. “Forgotten fungi—the gut mycobiome in human health and disease”. FEMS Microbiology Reviews;” 2017; 41 pp: 479–511.
- Hoffmann C., Dollive S., Grunberg S. et al. “Archaea and fungi of the human gut microbiome: correlations with diet and bacterial residents”. PLoS One 2013; 8: e66019.
- Scanlan P.D., Marchesi JR. “Micro-eukaryotic diversity of the human distal gut microbiota: qualitative assessment using culture-dependent and-independent analysis of faeces”. ISME J2008; 2:1183–93.
- Suhr M.J., Banjara N., Hallen-Adams H.E. “Sequence-based methods for detecting and evaluating the human gutmycobiome”. Lett Appl Microbiol 2016; 62:209–15.