Caratteristiche
La colite pseudomembranosa, conosciuta anche come entercolite pseudomembranosa (CPM) è una condizione clinica infiammatoria del colon, caratterizzata dalla presenza di placche bianco-giallastre che formano delle pseudomembrane sulla mucosa intestinale. Nella maggioranza dei casi colpisce principalmente il colon sinistro e il retto. Tale condizione clinica è associata il più delle volte all’azione delle tossine A e B prodotte dal Clostridioides difficile (già Clostridium difficile) normalmente presente nel microbiota intestinale umano; si associa di frequente all’utilizzo di antibiotici che, andando ad alterare la flora intestinale creando una disbiosi, favoriscono la proliferazione di batteri anaerobi quale il C. difficile con conseguente sviluppo di tale patologia.
Eziologia
La CPM il più delle volte si associa ad infezione da C. difficile, ma esistono altre cause e soprattutto altri agenti patogeni che sono in grado di innescare tale processo morboso; ricordiamo, nelle cause ad eziologia non infettiva: alcuni farmaci (es. Cisplatino, Ciclosporina A), la malattia infiammatoria intestinale (IBD), la malattia di Behçet, eventuali complicanze della chirurgia del colon-retto. Nelle cause ad eziologia infettiva, altri agenti patogeni responsabili della colite pseudomembranosa sono la Yersinia enterocolitica, l’Entamoeba histolytica, Shigella spp, Salmonella enterica. Il C. difficile rimane comunque la causa primaria di questa patologia.
Patogenesi, segni e sintomi
La colite pseudomembranosa da C. difficile è causata dalla produzione delle tossine A (enterotossina) e B (citotossina) che agiscono a livello della mucosa intestinale creando un abnorme quadro infiammatorio; in particolare l’enterotossina A induce una dilatazione emorragica che assieme all’effetto citotossico della tossina B comporta diarrea – anche emorragica, forti algie addominali e febbre. A causa dei molteplici episodi diarroici, il paziente può andare incontro a disidratazione ed ipotensione, mentre nei casi più gravi può essere presente perforazione dell’intestino crasso e megacolon tossico, altra complicanza che rientra nelle emergenze mediche da C. difficile.
L’azione delle tossine crea nel colon la formazione di caratteristiche placche bianco-giallastre (Fig. 1) che alterano completamente la struttura intestinale, con presenza di muco, detriti necrotici e materiale fibropurulento, visibili all’esame endoscopico (colonscopia). Il danno epiteliale è seguito da un processo necrotico con possibile distacco delle stesse placche e successivo sanguinamento, può inoltre essere presente edema ed un importante infiltrato di granulociti neutrofili.

Epidemiologia
A livello epidemiologico riesce difficile riuscire a fare una stima di quanto tale patologia sia diffusa. La CPM conseguente ad infezione da C. difficile pone indirettamente l’attenzione su quanto sia diffusa l’infezione stessa, in particolare in ambito ospedaliero. L’infezione da Clostridioides difficile è infatti un problema sanitario di particolare importanza che pone l’attenzione sulle infezioni correlate all’assistenza e su quanto sia necessario attuare strategie di prevenzione a livello globale. La CPM da C. difficile è la quarta malattia nosocomiale ad eziologia infettiva maggiormente riscontrata e riguarda circa il 10% delle diarree associate ad antibiotici. Dinamiche ospedaliere come prolungati ricoveri, pazienti immunocompromessi, interventi chirurgici, sono a maggior rischio di infezione e relative conseguenze.
Diagnosi e test di laboratorio
La diagnosi di CPM generalmente è endoscopica, attraverso la colonscopia che permette il riscontro e la localizzazione delle placche formate. Di supporto nella diagnosi rientrano anche gli esami radiologici quali TAC, rx addominale e clisma opaco.
Per attuare il prima possibile la terapia è fondamentale la diagnosi differenziale, poiché la sintomatologia può essere simile ad altre patologie ma soprattutto ad altri agenti patogeni che causano malattia enterica; a tal proposito la richiesta ed esecuzione dell’esame parassitologico e colturale delle feci è indispensabile per la corretta e tempestiva impostazione della terapia migliore. L’esame colturale delle feci esclude la presenza di Salmonella spp, Shigella spp, Campylobacter jejuni e Campylobacter coli, Yersinia enterocolitica e ceppi di Escherichia coli enteropatogeni, mentre l’esecuzione dell’esame parassitologico è di valido aiuto per escludere la presenza di eventuali amebe intestinali.
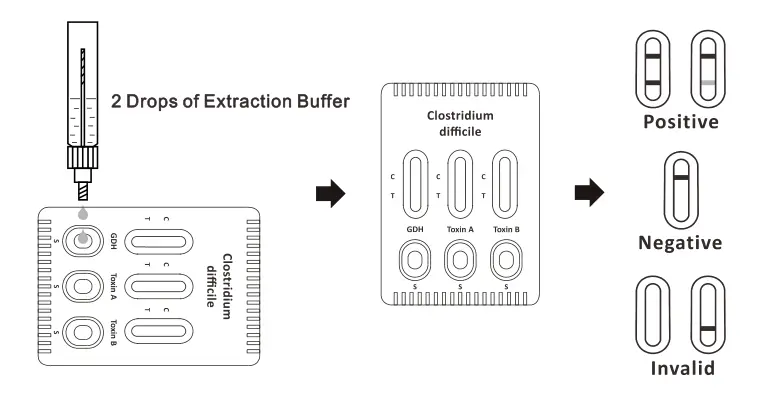
La ricerca del C. difficile avviene in prima istanza con l’esecuzione di un test rapido immunocromatografico (Fig. 2) che rileva la presenza del GDH, l’enzima glutammato deidrogenasi, e la presenza della tossina A e della tossina B. Il test viene svolto in urgenza dal personale tecnico di laboratorio ed in caso di positività il reparto deve essere avvisato il prima possibile. Successivamente, le feci positive per C. difficile possono essere messe in coltura con i terreni selettivi appositi (Clostridium Difficile Agar with 7% Sheep Blood e CHROMID® C. difficile agar) e incubati a 37 °C in CO2 per 24-48 ore. A livello biochimico, sono generalmente presenti leucocitosi prettamente neutrofila, alterazione dei parametri renali con iperazotemia ed ipoalbuminemia ed in caso di disidratazione severa può essere presente un’alterazione degli elettroliti, come sodio, potassio, calcio e magnesio.
Terapia
Prima della diagnosi effettiva di CPM da C. difficile è necessario attuare un trattamento empirico del quadro clinico onde evitarne un repentino aggravamento. Fondamentale è la reintegrazione di liquidi, di supporto l’assunzione di probiotici e nei casi più lievi va immediatamente sospeso l’eventuale antibiotico responsabile della proliferazione eccessiva di C. difficile ed isolamento del paziente per evitare ulteriori contagi.
Nei casi più gravi il trattamento della CPM si basa sull’eliminazione del C. difficile con metronidazolo e vancomicina; alcune review hanno stabilito che anche un trattamento a base di bacitracina, teicoplanina, rifaximina e/o acido fusidico può essere efficace. I farmaci come la loperamide vanno in genere evitati poiché, bloccando il processo diarroico, possono prolungare il disturbo mantenendo la tossina nell’intestino. Negli ultimi anni, anche l’antibiotico fidaxomicina ha dato ottimi risultati nel trattamento dell’infezione.
Infine, per quanto concerne eventuali attività preventive e di controllo delle infezioni da C. difficile, esse riguardano: evitare l’utilizzo improprio di antibiotici, diagnosi tempestiva, isolamento e precauzioni da contatto ed igiene delle mani, soprattutto a livello ospedaliero.
Priscilla Caputi
Fonti
- Moroni M., Antinori S., Mastroianni C. Manuale di Malattie Infettive. Edra, 2020.
- Kenneth J. Ryan, C. George Ray. Sherris, Microbiologia Medica. The McGraw Hill Companies, 2017. Edizioni Mediche Scientifiche Internazionali.
- Borgia G., Gentile I., Coppola N., Battista Gaeta G. Malattie infettive e tropicali. Edizioni Idelson Gnocchi, 2020.
- Harrison., Principi di Medicina Interna. Casa Editrice Ambrosiana, 2021.
- Cummins, A. J. (1961). Pseudomembranous enterocolitis and the pathology of nosology. The American Journal of Digestive Diseases, 6(5), 429-431.
- Janvier, J., Kuhn, S., & Church, D. (2008). Not all pseudomembranous colitis is caused by Clostridium difficile. Canadian Journal of Infectious Diseases and Medical Microbiology, 19(3), 256-257.
- Spizzirri A. La colite pseudomembranosa. 2 Iter formativo in Colonproctologia, 2008.
- Orazi D. Epidemiologia, diagnosi microbiologica e clinica della infezione da Clostridium difficile. Accademia Lancisiana.
- http://journals.seedmedicalpublishers.com/index.php/cmi/article/view/1158/1409
- https://www.microbiologiaitalia.it/parassitologia/entamoeba-histolytica/
- https://www.microbiologiaitalia.it/batteriologia/yersinia-enterocolitica/
- https://www.microbiologiaitalia.it/batteriologia/shigella-dysenteriae/
- https://www.microbiologiaitalia.it/batteriologia/clostridium-difficile/
Crediti immagini: