Sono anni che la comunità scientifica cerca una correlazione specifica tra il rischio d’insorgenza delle malattie neurodegenerative, in primis morbo di Parkinson, e le infezioni causate dai microrganismi patogeni. Questo perché, nonostante sia stata confermata la presenza di fattori genetici predisponenti la suddetta malattia (Figura 1), si fa ancora riferimento ad essa (a giusta causa) come ad una malattia sporadica ed idiopatica.
Recentemente si è voluto ricercare un legame tra disbiosi intestinale e stato di salute mentale di un individuo, per via di una forte relazione, più che reale, tra microbiota umano e cervello, anche detta asse-intestino-cervello, o anche di una possibile connessione con diverse forme di infezione batterica. Di seguito, però, ci occuperemo distintamente del nesso sussistente tra virus influenzali e neurodegenerazione.

Breve panoramica sul virus dell’influenza A
Appartenente all’ampia famiglia degli Orthomyxoviridae (Figura 2), di cui fanno parte anche gli Influenzavirus B e gli Influenzavirus C, il virus dell’influenza A è un virus a RNA a singolo filamento in grado di dare vita ad epidemie poiché si diffonde con molta facilità sia tra i mammiferi (compreso l’uomo) che tra gli uccelli.
L’aria come veicolo di agenti patogeni
La trasmissione è molto semplice: essa prevede che il microorganismo sia rilasciato tramite le goccioline di Flugge con colpi di tosse o starnuti. Flugge fu un batteriologo in grado di dimostrare che gli starnuti e la tosse producessero delle microgocce di saliva, vapor acqueo, muco e agenti infettanti in grado di rimanere sospese in aria: le goccioline più grandi sedimentano in breve tempo ed i germi in essi contenuti e che aderiscono alle polveri, possono essere risospesi in aria nuovamente ed inalati. Le goccioline più piccole evaporano facilmente formando i doplet nucleici che una volta aspirati raggiungono direttamente gli alveoli.
La caratteristica principale dei doplet nucleici è che, date le dimensioni, possono restare sospesi nell’atmosfera a lungo, propagando le infezioni a notevoli distanze. L’aria diventa così un veicolo di agenti patogeni permettendo una trasmissione indiretta delle infezioni principalmente a carico dell’apparato respiratorio, come l’influenza. Non di rado si può contrarre l’influenza anche se si viene a contatto con fluidi corporei infetti o superfici contaminate.
Particolarità degli Orthomyxoviridae
Il genoma virale codifica sempre per 11 proteine, tra le più importanti delle quali vi sono le proteine matrici (M1 ed M2) e le proteine strutturali/di adesione: emoagglutinina (H) e neuroaminidasi (N). Il genoma si presenta segmentato e le 8 diverse sezioni che lo compongono sono tenute assieme tra loro da legami ad idrogeno.
Questa struttura permette il cosiddetto riassortimento genico (tipico dei virus influenzali), consistente in un vero e proprio rimescolamento dei frammenti di RNA (al pari del crossing-over meiotico) e che si verifica quando vi è l’infezione di uno stesso organismo da parte di ceppi virali differenti.
Gli eventi di co-infezione da parte di sottotipi virali di una stessa specie sono estremamente rari ma alla base della trasformazione del materiale genetico che dà poi origine ai vari fenotipi virali, diversi sia dall’uno che dall’altro ceppo originario. I virus “ibridi” o “mutanti” presentano quasi sempre struttura e capacità del tutto nuove: requisiti fondamentali che ne consentono la sopravvivenza tramite l’infezione di nuove specie o l’abbattimento delle difese immunitarie dell’ospite.

Un virus in grado di mutare
Ceppo, sottotipo, stipite virale: tutti sinonimi che stanno ad indicare virus appartenenti alla stessa specie e che differiscono tra loro per piccolissime porzioni di genoma, come un frammento.
Per quanto concerne il virus dell’influenza A, sono stati scoperti almeno 18 sottotipi virali. Un numero così elevato è spiegato dall’esistenza di moltissime isoforme di due glicoproteine espresse tipicamente sulla superficie dei virus influenzali, che ne favoriscono l’adesione alla cellula infettata: l’emoagglutinina e la neuroaminidasi.
Le proteine antigeniche
Il coinvolgimento dell’emoagglutinina spiega, in parte, come mai l’infezione causata dai virus influenzali rimanga confinata a livello dell’apparato respiratorio: trattasi di una glicoproteina antigenica (il nome origina proprio dal fatto che induce il fenomeno di agglutinazione nelle emazie dopo il legame con l’acido sialico presente sulla membrana delle stesse) in grado di creare un legame con l’acido sialico presente sulla superficie delle cellule epiteliali a livello bronchiale e polmonare ed è quindi essenziale per l’internalizzazione del virus tramite endocitosi. A livello dell’apparato respiratorio il virus si riproduce ma i virioni vengono inattivati dalle triptasi mastocitarie, impedendone la diffusione in altri distretti.
La neuroaminidasi è invece un enzima essenziale per la diffusione del virus difatti in sua assenza o in mancanza di un adeguato funzionamento dello stesso i virioni rimarrebbero intrappolati nella membrana plasmatica andando a formare degli agglomerati di particelle virali, abbastanza grandi da rimanere bloccati nel muco. Il compito della neuroaminidasi è dunque quello di catalizzare la reazione di idrolisi dell’acido sialico e favorire la fuoriuscita del virus dalla cellula ospite, dopo replicazione dello stesso.
Entrambe le proteine rappresentano i bersagli dei farmaci antivirali e la risposta anticorpale è usata poi per classificare i diversi tipi di influenza A. Ogni sottotipo virale determina un quadro patologico differente e contagia specie animali diverse (Figura 3).

Ceppi virali di interesse storico
L’accumulo di mutazioni nei due siti antigenici è, dunque, proprio ciò che causa la comparsa di un nuovo ceppo virale. Una volta fatta la sua comparsa, il virus deve adattarsi al nuovo ospite e far emergere le sue caratteristiche: tutto ciò richiede un numero molto elevato di cicli virali i quali consentono una più rapida espansione del virus stesso all’interno del corpo infettato. Una rapida maturazione del virus, intesa in termini di virulenza, favorisce a sua volta la diffusione da un soggetto recettivo all’altro.
In poche parole i virus mutanti sono solitamente più virulenti ed in grado di determinare in pochissimo tempo epidemie e, talvolta, anche pandemie. È il caso del virus dell’influenza A sottotipo H1N1 ad esempio, che per ben due volte nel corso della storia umana ha allarmato l’Organizzazione Mondiale della Sanità (OMS).
H1N1: la prima pandemia del XX secolo
Anno 1918, c’è un nemico che miete più vittime della Grande Guerra in corso: è l’influenza spagnola! Un’influenza che infettò circa 500 milioni di persone in tutto il mondo uccidendone decine di milioni. Non furono risparmiati neppure gli abitanti di territori alle estremità del globo, come le isole del Mar Glaciale Artico. È stata la più letale pandemia della storia umana, più della peste nera del XIV secolo. Causata dal virus dell’influenza A sottotipo H1N1, l’influenza colpiva giovani adulti in buona salute, donne, anziani e bambini, senza esclusione di colpi, abbassando così l’aspettativa di vita del XX secolo. Ancora non è chiaro se si trattò di una forma di virus insolitamente aggressiva o se sono state le condizioni, già precarie, della popolazione (sovraffollamento, malnutrizione, guerra, povertà) a favorirne la diffusione. Pare, inoltre, che H1N1 sia alla base della comparsa, in quegli anni, dell’encefalite letargica: una patologia dell’encefalo di natura infiammatoria caratterizzata da ipersonno e dolori generali nella prima fase e parkinsonismi nella seconda fase (può verificarsi anche a distanza di molti anni). Si è ancor incerti sul luogo di origine della pandemia.
H1N1: un virus tenace
Nel 2009 il virus H1N1 torna a far parlare di sé. Si tratta di una nuova variante, fino ad allora sconosciuta. L’influenza, ancora una volta a carattere pandemico, viene denominata “suina” poiché per la prima volta si verificò in Messico in un allevamento di maiali. Centinaia di contagi e morti in tutto il mondo, specialmente nel continente americano: rapidamente il virus era stato in grado di adattarsi al nuovo ospite, l’uomo, per cui iniziò a trasmettersi senza più la necessità di un contatto diretto con il maiale infetto. Tra i sintomi più comuni febbre alta improvvisa e problemi respiratori che però non sembravano peggiorare con il consumo di carne di maiale, che dunque non ha mai rappresentato un rischio, previa adeguata cottura.
H5N1: un nuovo rischio
Un alto rischio di pandemia vi è sicuramente per il virus dell’influenza A sottotipo H5N1, che genera la cosidetta “influenza aviaria” (colpisce prevalentemente uccelli domestici e selvatici). Il virus si trasmette anche agli uomini ed è particolarmente resistente alle basse temperature mentre è abbattuto dalle alte temperature. H5N1, nel 2005, ha già dato origine ad un’epidemia nel Sud-Est Asiatico, ancora in atto, ed è arrivato anche in Italia, fortunatamente in una forma meno virulenta.
La neurodegenerazione indotta dal virus influenzale
Uno dei primi link tra virus influenzale e morte delle cellule neuronali risale al 1930 circa: si osservò difatti una correlazione tra l’influenza spagnola del 1918 ed l’aumento nella diagnosi del morbo di Parkinson alcuni decenni dopo.
Usando questo dato, un po’ incerto, come punto di partenza e basandosi su altre osservazioni quali la scoperta di un’anatra infettata dal virus influenzale H5N1 e caratterizzata da parkinsonismo, il neurobiologo Smeyne ed il suo team effettuarono un semplice esperimento in vivo che potesse confermare la loro ipotesi: scelti due gruppi di topini da laboratorio, nebulizzarono direttamente sul naso dosi non letali di H5N1 (primo gruppo) e H1N1 (secondo gruppo) monitorando attentamente il percorso effettuato dai virus per capire effettivamente se e come questi ultimi raggiungessero il Sistema Nervoso degli animali e quali danni fossero in grado di provocare. I risultati furono sorprendenti ma fu necessario affiancare ad una prima analisi comportamentale degli studi anatomo-patologici in sede autoptica.
Risultati della ricerca
Con ogni probabilità il sottotipo virale H5N1 si era infiltrato agevolmente nel cervello dei topi utilizzati per l’esperimento, senza trovare alcuna difficoltà nell’oltrepassare la barriera emato-encefalica, altamente selettiva. Inoltre, era chiaro che il virus mostrava una certa preferenza per i neuroni di natura dopaminergica presenti nella substantia nigra a livello mesencefalico, dalla cui degenerazione si genera il morbo di Parkinson.
Non si osservò invece la presenza del ceppo influenzale H1N1 nel cervello dei topi che avevano subito il trattamento con questo specifico sottotipo virale. Contemporaneamente però si avvertì una massiccia attivazione del Sistema Immunitario degli stessi animali. In particolar modo si attivarono, a difesa del Sistema Nervoso, le cellule microgliali della via nigro-striatale dell’ippocampo, causando infiammazione e morte cellulare. Si ipotizzò che il sottotipo virale H1N1 era impossibilitato, per una ragione ancora poco nota, ad attraversare la barriera emato-encefalica.
L’ipotesi dell’origine intestinale
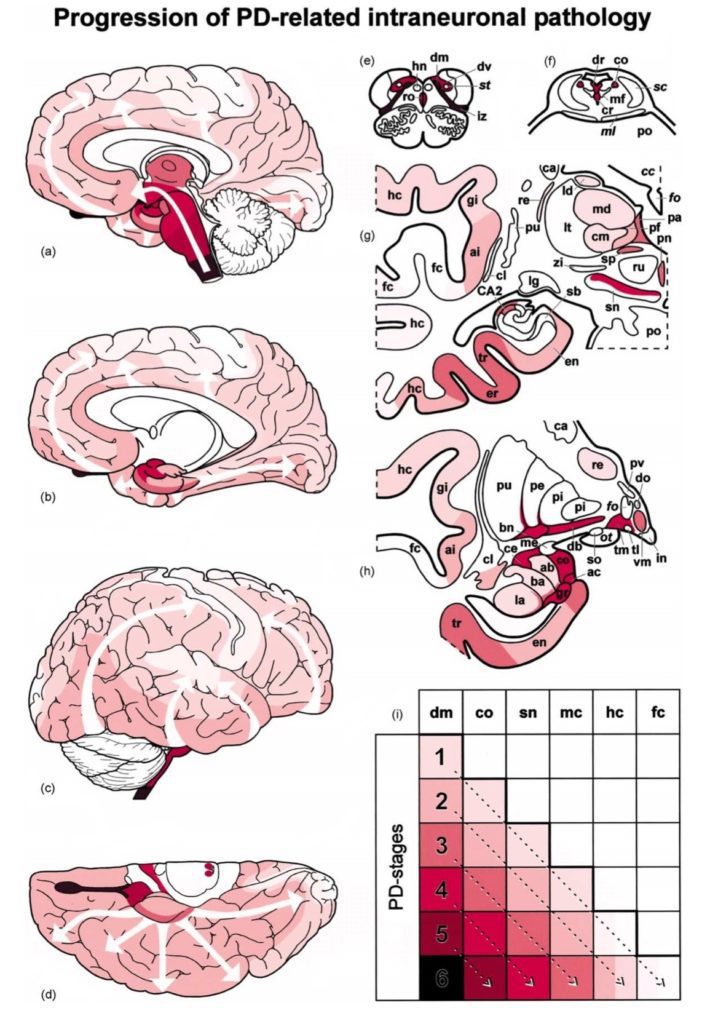
Smeyne ed i suoi collaboratori suggerirono anche un possibile percorso utilizzato dal virus per instaurarsi all’interno del Sistema Nervoso: risalire attraverso il nervo vago. L’ipotesi è più che probabile e coincidente con lo schema proposto dal neuropatologo Braak nel 2003 (Figura 4), secondo cui il Parkinson ha origine dall’intestino manifestandosi dapprima con infiammazione del tratto gastro-intestinale e problemi digestivi e successivamente, col progredire della malattia, come un insieme di difficoltà motorie e problemi cognitivi.
Secondo Braak i sintomi propri del morbo di Parkinson, comuni a tutti i pazienti affetti dalla malattia ed identificabili nella triade “bradicinesia, tremore e rigidità”, sono secondari poiché la malattia si diffonde a partire dal Sistema Nervoso enterico (facente parte a sua volta del Sistema Nervoso autonomo). Quest’espansione avviene nell’uomo nell’arco di 25 o 30 anni ma nei roditori si osserva già in poche settimane ed è per questo che gli studi in vivo sono di gran supporto.
Stando a quanto appena detto le lesioni si verificano inizialmente nel nervo glossofaringeo e, frequentemente, anche nel nucleo olfattivo anteriore. Questo può spiegare il motivo per cui alcuni pazienti affetti da Parkinson abbiano difficoltà a riconoscere alcuni odori. Successivamente vi è il coinvolgimento del Sistema Nervoso enterico che porta ad avere sintomi gastrointestinali ed infine, solo in un’ultima fase, sono chiamate in causa le strutture cerebrali. Tra le prime vi sono i nuclei del rafe e la pars compacta della substantia nigra.
Ad oggi l’ipotesi di Braak è ampliamente accettata poiché effettivamente è stata osservata una strana correlazione tra le malattie dell’apparato digerente e le successive alterazioni neurodegenerative, tipiche dei pazienti col Parkinson.
Conclusioni
E dunque due diversi virus, due diversi meccanismi, un unico effetto: morte neuronale nelle regioni cerebrali in cui maggiormente si sintetizza dopamina, cosa che, verosimilmente, è alla base della malattia di Parkinson.
Interessante sarebbe poter indagare ulteriormente, andando ad esempio a constatare l’effettiva presenza di parkinsonismi, tremori e altre disfunzioni motorie nei soggetti umani infettati dal virus H5N1 che, tra i due, ha portato a risultati più tangibili nella fase iniziale della sperimentazione. Ad oggi però l’effettivo legame tra virus influenzale e neurodegenerazione è ancora molto discutibile.
Sicuramente gli studi sono da approfondire, visto anche il rischio concreto di pandemia connesso al sottotipo virale H5N1 e le gravi conseguenze che comporterebbe.
Carla Caianiello
Fonti:
- http://biologi-ed.blogspot.com/2012/08/virologi_12.html
- https://it.wikipedia.org/wiki/Malattia_di_Parkinson
- https://teddybrain.wordpress.com/2013/09/01/neuropathology-and-braak-staging-of-parkinsons-disease/
- https://www.lacooltura.com/2018/05/morbo-di-parkinson/
- https://www.the-scientist.com/features/can-the-flu-and-other-viruses-cause-neurodegeneration–65498