Un batteriofago per uccidere le cellule tumorali? Questa possibilità emerge da un nuovo studio condotto dall’Università di Bologna sostenuto dalla Fondazione AIRC. Il gruppo di ricerca ha modificato geneticamente e chimicamente il fago M13 per indirizzare la terapia fotodinamica selettivamente verso le cellule del tumore.
Ma prima un passo indietro…
Cos’è la terapia fotodinamica?
La terapia fotodinamica è un trattamento non invasivo utilizzato sia contro patologie dermatologiche sia contro certi tipi di tumori. Si basa sull’utilizzo di molecole dette “fotosensibilizzatori” (photosensitizer) che vengono attivate tramite un raggio di luce ad una specifica lunghezza d’onda. L’energia proveniente dalla radiazione luminosa viene sfruttata dai fotosensibilizzatori insieme all’ossigeno disponibile nella cellula per innescare la produzione di specie reattive dell’ossigeno (ROS). Queste specie vengono prodotte solo all’interno delle cellule maligne, poiché le molecole penetrano selettivamente solo in queste, facendo morire di stress ossidativo esclusivamente le cellule dannose.
La natura dei composti utilizzati varia in base allo scopo. Per patologie cutanee come lesioni dovute a fotodanneggiamento o a invecchiamento cutaneo, cheratosi attiniche o solari e acne, si utilizza solitamente acido aminolevulinico, applicato direttamente sulla pelle. Invece, per i trattamenti antitumorali, viene impiegata l’ematoporfirina e i suoi derivati, tramite somministrazione endovenosa.
Selettività della terapia
La terapia fotodinamica è altamente selettiva grazie a due aspetti. Il primo è dato dall’accumulo dei fotosensibilizzatori solo all’interno delle cellule tumorali. Si pensa che questa distribuzione sia dovuta alla tendenza di queste sostanze a interagire preferenzialmente con le LDL (lipoproteine a bassa densità) presenti nel siero. L’assorbimento delle LDL è maggiore nelle cellule tumorali, poiché hanno bisogno di più colesterolo per costruire le nuove membrane durante le rapide divisioni mitotiche. Di conseguenza, le lipoproteine sono una sorta di trasportatori dei fotosensibilizzatori all’interno delle cellule cancerose.
Il secondo aspetto è dato dalla possibilità di attivare queste molecole solo nell’area interessata, circoscrivendo la zona che viene “illuminata”. Tuttavia, se le sostanze sono applicate per via sistemica, raggiungono tutti i tessuti dell’organismo. Perciò, ci possono essere effetti collaterali se l’individuo si espone a fonti luminose in seguito al trattamento.
Per diminuire gli effetti sistemici e migliorare l’efficienza della terapia, si è cercato di coniugare i fotosensibilizzatori con sostanze altamente affini al tumore, in modo da permettere l’entrata del farmaco solo nelle cellule target. Ad esempio, si possono coniugare ad un anticorpo monoclonale diretto verso uno specifico antigene del tumore, oppure alle LDL, dato che le cellule tumorali sovraesprimono i recettori per queste lipoproteine. Un’altra modifica molto studiata finora è la coniugazione con nanoparticelle (come l’acido poli(lattico-co-glicolico), il poletilenglicole o nanoparticelle d’oro) che permettono un drug delivery mirato e aumentano la stabilità dei fotosensibilizzatori.
Ciò che tuttavia rende innovativo l’utilizzo della terapia fotodinamica è la sua combinazione con il fago M13.
Caratteristiche del fago M13
Il batteriofago M13 è molto utilizzato per scopi biotecnologici, grazie alle sue caratteristiche favorevoli. Prima di tutto, essendo un fago, è un virus che infetta batteri, quindi è innocuo per animali, piante o esseri umani. Il suo genoma è costituito da DNA a singolo filamento, e questo lo rende un vettore conveniente per il clonaggio del DNA. Inoltre, la lunghezza del suo genoma è variabile, perciò si possono inserire facilmente porzioni di DNA estraneo senza compromettere la sua vitalità. Questa caratteristica è sfruttabile per modificarlo geneticamente inserendo nel suo genoma sequenze di peptidi di interesse, in modo che vengano espressi ed esposti sul suo capside.
Le sue dimensioni sono molto piccole (lungo 1000 nanometri ma largo appena 5), e queste consentono al fago di penetrare all’interno dei tessuti tumorali in punti non raggiungibili da anticorpi o altre nanoparticelle. Il fago riesce anche a penetrare la barriera ematoencefalica, risultando un possibile futuro vettore di trattamenti per il cervello.

Rendere il fago un vettore per la terapia fotodinamica
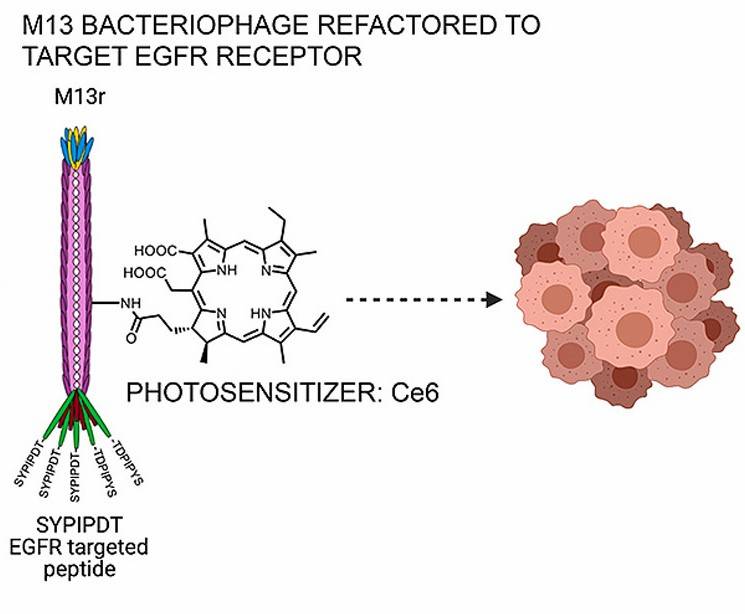
Proprio per questi aspetti favorevoli, il fago M13 è stato scelto dai ricercatori dell’Università di Bologna come trasportatore dei fotosensibilizzatori alle cellule tumorali, al fine di rendere la terapia fotodinamica ancora più selettiva. Per fare ciò, hanno modificato geneticamente il fago inserendo la sequenza per il peptide che lega il recettore EGFR (Epidermal Growth Factor Receptor), in modo che venisse esposto sul capside. Questo recettore è maggiormente espresso sulla membrana delle cellule tumorali A431, utilizzate nello studio. Per questo motivo, i fagi che hanno esposto il peptide che lega il recettore EGFR vengono internalizzati da queste cellule. Successivamente il fago è stato modificato anche chimicamente, coniugando sul capside centinaia di molecole di rosa bengala, un fotosensibilizzatore.
Il fago così modificato svolge la sua funzione di vettore della terapia fotodinamica, venendo internalizzato selettivamente dalle cellule tumorali. I fotosensibilizzatori si attiveranno quindi solo all’interno di queste cellule. In vitro, una volta irradiate le cellule, queste muoiono per stress ossidativo, ma nei modelli in vivo ci sono ulteriori effetti antitumorali della terapia. Infatti, è in grado di distruggere i vasi sanguigni all’interno della massa tumorale, facendo morire ulteriormente le cellule attorno a questi vasi danneggiati. In più, attiva maggiormente il sistema immunitario contro il tumore, perché, distruggendo la massa tumorale, attiva l’infiammazione.
Conclusioni
Questa nuova piattaforma potrebbe essere utilizzata sia come terapia a sé stante che in combinazione con altri trattamenti antitumorali. L’intero sistema è stato finora testato solo in vitro, ma se arriverà alle sperimentazioni precliniche e cliniche, contribuirà a ridurre drasticamente gli effetti collaterali delle terapie antitumorali. Ciononostante, sarà necessaria un’ulteriore ottimizzazione, allo scopo di “camuffare” il fago ed evitare un attacco del sistema immunitario durante iniezioni successive.
Ulteriori limiti finora presenti sono la scarsa presenza di ossigeno nelle masse tumorali, reagente indispensabile per la terapia fotodinamica, e la difficoltà per la luce di raggiungere i tessuti interni. Ad ogni modo, sono già in studio delle alternative. Nelle zone ipossiche è possibile che i fotosensibilizzatori sviluppino calore invece che i radicali dell’ossigeno, facendo morire le cellule grazie a temperature elevate (50°). Al posto della luce è possibile utilizzare ultrasuoni per eccitare le molecole, dal momento che questi arrivano più in profondità nei tessuti.
Infine, questo approccio potrebbe essere adoperato non solo contro i tumori, ma anche per combattere la resistenza agli antibiotici, modificando il fago in modo da indirizzarlo verso diversi tipi cellulari.
Fonti
- https://www.humanitas-care.it/cure/terapia-fotodinamica/
- https://www.my-personaltrainer.it/benessere/terapia-fotodinamica.html
- https://www.sciencedirect.com/science/article/pii/S0753332218341611?via%3Dihub
- https://www.airc.it/area-stampa/ci-sono-anche-virus-buoni-sviluppato-un-vettore-virale-fotoattivo-per-la-terapia-antitumorale
- https://www.osservatorioterapieavanzate.it/innovazioni-tecnologiche/altre-innovazioni/un-virus-contro-il-cancro-che-si-attiva-con-la-luce
- https://pubs.rsc.org/en/content/articlelanding/2022/NR/D1NR06053H
- https://www.sciencedirect.com/science/article/pii/S0891584921008169?via%3Dihub
Crediti immagini
- Immagine in evidenza: molecularlab.it
- Immagine 1: https://www.sciencedirect.com/science/article/pii/S0891584921008169?via%3Dihub#fig1
- Immagine 2: https://www.researchgate.net/publication/259821421_Desarrollo_de_herramientas_inmunologicas_y_estudio_de_la_organogenesis_del_sistema_olfatorio_del_rodaballo_Scophthalmus_maximus_L