La cromatografia in colonna è una specifica tecnica cromatografica utilizzata per la separazione dei componenti, presenti all’interno di una miscela complessa, attraverso una colonna adsorbente.
Generalità
Gli elementi della cromatografia in colonna includono:
- La fase stazionaria: costituita da microparticelle di gel di silice, allumina, poliammide impaccate all’interno di lunga colonna di vetro;
- La fase mobile: rappresentata da una soluzione che “scorre” sulla fase stazionaria consentendo il trasporto e la separazione dei componenti della miscela d’interesse.
La miscela da separare viene, quindi, disciolta nella stessa soluzione utilizzata per la fase mobile, stratificata sulla sommità della colonnina e fatta percolare attraverso la matrice solida. La soluzione diffonde lungo la colonna sottoforma di una banda e i singoli componenti migrano più o meno velocemente in base alle loro proprietà. Per ciascuna tipologia di colonna cromatografica, le frazioni sono ottenute con diverse concentrazioni saline o con diversi tempi di eluizione e, successivamente, sono saggiate per la molecola d’interesse che si vuole isolare.
Modalità di eluizione degli analiti nella cromatografia in colonna
L’eluizione degli analiti può avvenire attraverso due modalità:
- Modalità isocratica: la concentrazione della fase mobile è costante durante tutto il processo cromatografico. In questo caso, nel cromatogramma, l’ampiezza del picco aumenta linearmente con il tempo di ritenzione. Tuttavia, i picchi ad eluizione tardiva diventano molto piatti e ampi perdendo, quindi, di risoluzione;
- Modalità a gradiente: la concentrazione della fase mobile non rimane costante durante il processo cromatografico. In questo caso, la fase mobile è costituita da due componenti: un solvente debole ed uno forte. Il solvente debole consente al singolo analita di eluire lentamente mentre il solvente forte provoca la rapida eluizione dell’analita stesso.
Al termine della colonna, le frazioni sono raccolte o manualmente, mediante l’ausilio di provette, oppure usando sistemi automatizzati di raccolta. Successivamente possono essere ulteriormente analizzate e purificate.
Nella parte finale della colonna, inoltre, si trova un rivelatore in grado di creare il cromatogramma degli analiti in uscita dalla colonna. È possibile utilizzare vari metodi di rilevamento, come la misurazione dell’assorbimento visibile o ultravioletto o della fluorescenza. I segnali del rivelatore sono registrati utilizzando un registratore grafico, il quale realizza il tracciato cromatografico. Ogni analita è rappresentato come un picco sul cromatogramma. Sul grafico è riportato, per ogni picco, il tempo di ritenzione sull’asse delle ascisse e l’assorbanza sull’asse delle ordinate.
Tempo di ritenzione
A differenza della cromatografia su carta e della cromatografia su strato sottile, in cui si calcolano i fattori di ritenzione, nella cromatografia in colonna si calcolano i tempi di ritenzione. In particolare, i fattori di ritenzione sono misurazioni della distanza percorsa da ciascun componente della miscela attraverso la fase stazionaria rispetto alla distanza percorsa dal solvente. I tempi di ritenzione, invece, rappresentano il tempo che intercorre tra l’iniezione del campione e la rilevazione di ogni singolo componente.
Teoricamente, lo stesso analita ha sempre lo stesso tempo di ritenzione, a condizione che siano mantenute invariate le condizioni di analisi (temperatura, fase stazionaria, fase mobile, lunghezza della colonna ecc.). In realtà, riprodurre le stesse condizioni cromatografiche per ottenere tempi di ritenzione coerenti, non è così semplice ed è per questo che la cromatografia in colonna tradizionale (LPC) non può essere utilizzata per identificare i vari componenti ma è necessario ricorrere, ad esempio, alla cromatografia liquida in colonna ad alta prestazione (HPLC).
Principio di separazione della cromatografia in colonna
In base al principio di separazione, la cromatografia liquida in colonna può essere:
- A scambio ionico;
- Ad esclusione dimensionale;
- Per affinità.
Cromatografia a scambio ionico
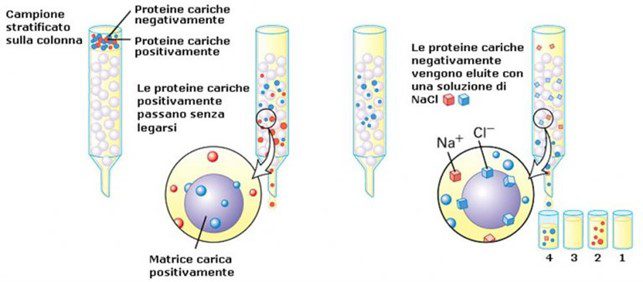
La cromatografia in colonna a scambio ionico prevede una separazione basata sulle interazioni elettrostatiche tra analiti carichi e siti di carica opposta presenti sulla fase stazionaria. La matrice della colonna (resina) è un polimero sintetico costituito da piccole sfere di acrilammide o di agarosio contenente gruppi chimici carichi positivamente o negativamente. In particolare, le resine con gruppi carichi negativamente sono dette scambiatori di cationi mentre quelle con gruppi carichi positivamente sono dette scambiatori di anioni (Fig. 1). Nella cromatografia a scambio cationico, ad esempio, la matrice solida possiede gruppi carichi negativamente per cui, nella fase mobile, le molecole con carica netta positiva migrano attraverso la matrice più lentamente rispetto a quelle con carica netta negativa.
Eluizione nella cromatografia in colonna a scambio ionico
L’affinità di ciascun analita per i gruppi carichi della colonna, dipende sia dal pH che determina lo stato di ionizzazione della molecola, sia dalla concentrazione dei sali presenti nella fase mobile. In altre parole, le molecole che interagiscono maggiormente con la matrice necessitano di una maggiore quantità di sale per esser eluite. Il sale, infatti, “maschera” le regioni cariche permettendo il rilascio degli analiti stessi. Per migliorare il processo di separazione delle molecole, è buona prassi variare gradualmente il pH e/o la concentrazione salina della fase mobile in modo da creare un gradiente. Incrementando gradualmente la concentrazione del sale nel tampone di eluizione, anche gli analiti con caratteristiche di carica simili possono essere separati in frazioni distinte man mano che vengono eluite dalla colonna.
Cromatografia ad esclusione molecolare
Questa metodica consente di separare le molecole in base alla forma e alle dimensioni. Diversamente dalla cromatografia a scambio ionico, le sfere costituenti la fase stazionaria non sono dotate di gruppi chimici carichi bensì di pori e cavità di diverse dimensioni (Fig. 2). Molecole piccole possono, quindi, penetrare in tutti i pori e impiegano più tempo ad essere eluite mentre, molecole più grandi, non riescono a penetrarvi ed eluiscono più velocemente.

Cromatografia per affinità
La cromatografia per affinità si basa sulla formazione di specifici legami. I granuli con cui viene riempita la colonna sono legati covalentemente ad un gruppo chimico che prende il nome di ligando il quale è in grado, a sua volta, di interagire con una specifica macromolecola presente all’interno di una miscela complessa.
Quando si aggiunge alla colonna, ad esempio, una miscela di proteine, ogni specie proteica che ha affinità per il ligando si lega ai granuli; quindi, la sua migrazione attraverso la matrice viene rallentata. Dopo aver lavato via dalla colonna le molecole che non si sono legate, l’analita d’interesse potrà essere eluito con una soluzione contenente un’elevata concentrazione salina o lo stesso ligando libero (Fig. 3). Il sale indebolisce il legame della proteina con il ligando immobilizzato interferendo con le interazioni ioniche. Il ligando libero, invece, compete con il ligando adeso ai granuli consentendo il distacco dell’analita d’interesse dalla matrice.

Cromatografia liquida in colonna ad alta prestazione (HPLC)
La risoluzione delle metodiche cromatografiche può essere incrementata dalla cromatografia liquida in colonna ad alta prestazione (HPLC). Tale tecnica, utilizza pompe ad alta pressione per aumentare la velocità di scorrimento degli analiti attraverso la colonna e, di conseguenza, sfrutta matrici cromatografiche in grado di sopportare elevate pressioni. Riducendo il tempo di transito attraverso la colonna, l’HPLC limita la diffusione delle bande migliorando notevolmente la risoluzione.
La gascromatografia (GC)
Un’altra tecnica cromatografica ad alta risoluzione largamente utilizzata è la gascromatografia (GC). A differenza della cromatografia liquida che può essere realizzata in colonna, su strato sottile e su carta, la gas cromatografia è limitata all’utilizzo della colonna.
In base alla tipologia di fase stazionaria, la gas cromatografia può essere:
- Cromatografia gas-solido: la separazione si basa sull’adsorbimento degli analiti su una fase stazionaria adsorbente solida.
- Cromatografia Gas-Liquida: la separazione si basa sulla ripartizione degli analiti tra una fase stazionaria liquida immobilizzata su un supporto solido ed una fase mobile gassosa. In questo caso, si verifica una vera e propria solubilizzazione delle sostanze nella fase stazionaria.
Per entrambe le tipologie di cromatografia, la fase mobile è sempre rappresentata da un gas (detto anche “gas carrier”). Generalmente, vengono scelti gas chimicamente inerti, a bassa viscosità ed ottenibili ad elevata purezza (99,9%) come l’azoto, l’elio o l’argon.
Limiti della gascromatografia
La limitazione più importante della cromatografia in colonna in fase gassosa è rappresentata dal fatto che il campione, per poter essere analizzato, deve essere volatile in un intervallo di temperatura compreso tra l’ambiente e i 350 °C circa. Pertanto, in alcuni casi, occorre effettuare una derivatizzazione del campione stesso che prevede la sostituzione di particolari gruppi funzionali delle molecole da separare consentendo di aumentare la volatilità degli analiti rendendoli, quindi, idonei all’analisi gas-cromatografica. Anche in questo caso, la miscela complessa viene separata nei suoi componenti in base alla loro affinità con la fase stazionaria e la fase mobile.
Gli analiti lasciano il sistema cromatografico in tempi diversi e possono essere rilevati singolarmente da un rivelatore. Quest’ultimo produce un segnale che viene utilizzato poi per creare un cromatogramma in cui vengono indicati i tempi di ritenzione di ogni componente della miscela. I picchi possono essere alti o bassi oppure larghi o stretti, pertanto, presentano aree diverse. L’area sottesa un picco è proporzionale alla quantità relativa dell’analita che raggiunge il rivelatore in un determinato momento. Pertanto, è possibile utilizzarla per determinare quantitativamente l’abbondanza percentuale di ciascun componente all’interno del campione.
Fonti
- Cromatografia a scambio ionico, per esclusione molecolare e per affinità (bmscience.net)
- Presentazione standard di PowerPoint (unifi.it)
- Gascromatografia: spiegazione, tipi e utilizzi | StudySmarter.