Complessità dell’encefalo umano
Lo sviluppo della neocorteccia dell’uomo è straordinariamente plastico e continuo. Sono stati individuati vari fenomeni che distinguono lo sviluppo del cervello umano:
- L’importante convoluzione della corteccia cerebrale;
- L’attività di geni per RNA specifici dell’uomo;
- Alta attività trascrizionale;
- La continua maturazione del cervello in età adulta.
I nostri cervelli grandi e convoluti sono parte di ciò che ci rende umani. La figura 1 è la fotografia di una scultura di Lisa Nilsson, che ha ripiegato in modo intricato della carta colorata per realizzare sezioni anatomiche di organi umani, in questo caso le pliche e le convoluzioni del cervello.
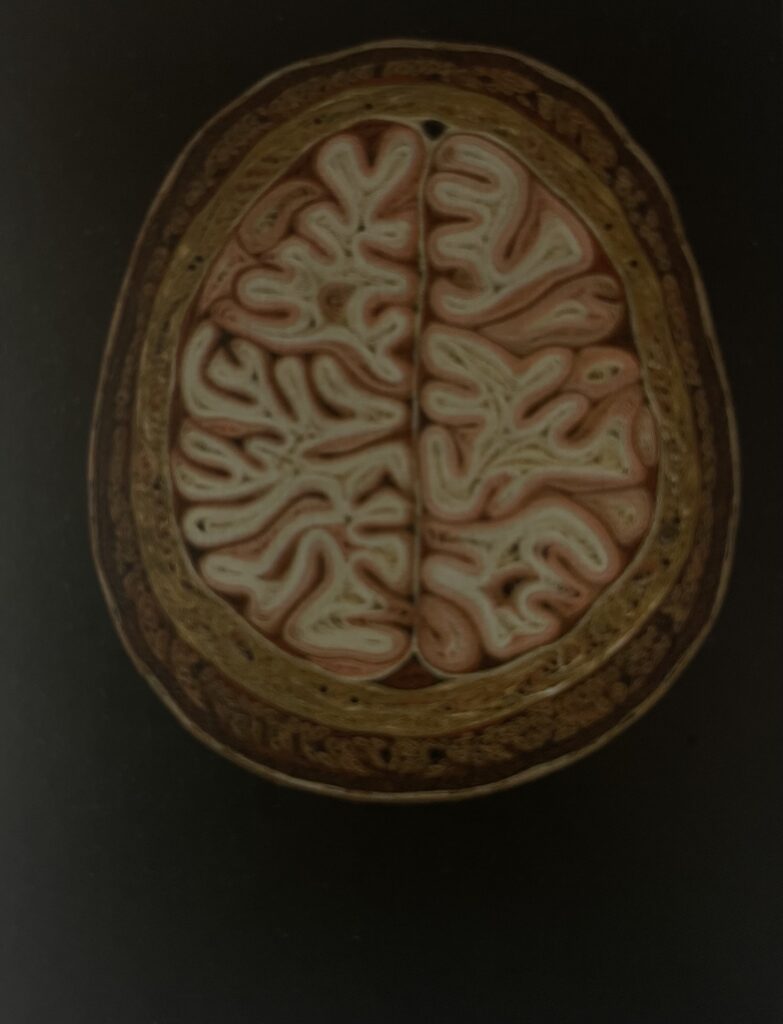
L’aumento del numero di cellule staminali nella corteccia e le modificazioni di un’esclusiva espressione genica costituiscono alcuni dei principali contribuiti alla complessità del cervello umano e sono alla base dell’evoluzione. Inoltre, durante l’età adulta, il cervello umano continua a crescere e si sviluppa in quella struttura fortemente mielinizzata così straordinaria da diventare un vero e proprio oggetto d’arte. Il numero e la complessità di giri e solchi (convoluzioni) della neocorteccia sono correlati con il livello d’intelligenza. Gli esseri umani presentano un’estesa convoluzione della corteccia e le cellule della glia radiale svolgono probabilmente un ruolo importante nello sviluppo di queste convoluzioni.
Plasticità neuronale
La plasticità neuronale rappresenta una proprietà caratteristica, ma non esclusiva, della corteccia cerebrale. Il nostro cervello è continuamente soggetto al flusso della stimolazione ambientale. Questo influisce sulle nostre capacità di percepire gli stimoli, compiere movimenti, pensare, apprendere, ricordare e pianificare strategie comportamentali. La plasticità è una caratteristica peculiare del sistema nervoso in sviluppo e con il passaggio all’età adulta si verifica una notevole
riduzione delle potenzialità plastiche dei circuiti nervosi. È stato dimostrato che per la plasticità neuronale è importante il mosaicismo tra neuroni indotto da retrotrasposoni.
I retrotrasposoni
I retrotrasposoni sono elementi mobili in grado di generare diversità genomica all’interno dello stesso individuo. Le cellule staminali embrionali hanno un’alta attività di elementi trasponibili e questo provoca plasticità neuronale. In particolare, la cellula progenitrice neuronale ha un’alta attività di LINE1, elemento trasponibile del genoma umano. La retrotrasposizione può avvenire nella linea germinale, durante l’embriogenesi, così come durante lo sviluppo del sistema nervoso, e può coinvolgere cellule staminali neurali (NSC).
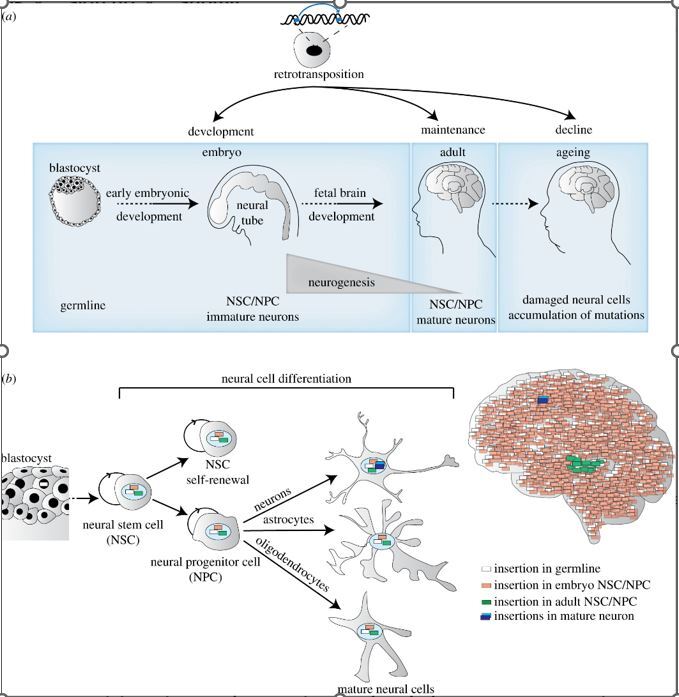
A partire dalla prima divisione dello zigote, lo sviluppo embrionale è regolato dall’attivazione di elementi trasponibili, necessari per la regolazione sequenziale dell’espressione genica specifica per ogni tipo cellulare. Questi processi includono la differenziazione delle cellule staminali neuronali che è influenzata dall’espressione dei geni neuronali in varie regioni del cervello. L’ippocampo è il centro della neurogenesi umana perché è stata identificata la più alta attività di elementi trasponibili , che causano il mosaicismo somatico delle cellule durante la formazione di specifiche strutture cerebrali. Gli elementi genetici mobili sono le fonti più importanti di lunghi RNA non codificanti che sono co-espressi con importanti geni codificanti proteine cerebrali. Anche i microRNA, molti dei quali derivano da trascritti di trasposoni, svolgono un ruolo importante nella regolazione della differenziazione delle cellule staminali neuronali. Pertanto, i trasposoni, attraverso i propri trascritti elaborati, prendono parte attiva alla regolazione epigenetica del differenziamento dei neuroni.
Neurogenesi embrionale
L’accrescimento dell’encefalo ha inizio con l’espansione del tubo neurale lungo l’asse apico-basale, all’interno di tre regioni: la zona ventricolare, zona intermedia e la zona marginale. Le cellule staminali denominate glia radiale si distendono attraverso questo neuroepitelio, proliferando e dando origine a cellule progenitrici o neuroni. Il potenziale di autorinnovamento e quello neurogenico di queste cellule staminali sono influenzati da numerosi fattori. (orientamento del fuso mitotico, la diversificazione dei segnali Notch, fattori mitogeni provenienti dal fluido cerebro-spinale). L’encefalo umano, grande e complesso, si è evoluto attraverso la modifica dei meccanismi che controllano la neurogenesi cerebellare, vale a dire l’espansione delle popolazioni progenitrici della glia radiale e l’espressione differenziale di geni specifici per la neurogenesi. Quest’ultima non termina alla nascita, ma rimane attiva in modi diversi per tutta la vita.
Neurogenesi adulta
Fino a poco tempo fa, la maggior parte degli studiosi riteneva che, dopo la crescita dei neuroni nello sviluppo fetale, non vi fossero più periodi di rapida proliferazione neurale. Tuttavia, studi di analisi per immagini in risonanza magnetica hanno dimostrato che il cervello continua a svilupparsi fin verso la pubertà, e che non tutte le aree del cervello maturano contemporaneamente. Le differenze maggiori tra il cervello all’inizio della pubertà e quello dell’inizio dell’età adulta interessano la corteccia frontale. Per il corretto funzionamento delle aree nervose è importante la mielinizzazione che continua nell’età adulta.
Negli anni ’90, quindi, si è scoperto che la neurogenesi esiste anche nell’adulto, anche se con un ritmo decisamente inferiore visto che si parla della creazione di 700 nuove cellule al giorno in media e inoltre l’entità di questo processo varia a seconda della specie. In generale, nell’uomo la neurogenesi adulta avviene nella zona subventricolare e nel giro dentato dell’ippocampo.
Le cellule staminali neurali maturano man mano che si spostano radialmente verso le zone esterne e possono arrivare a raggiungere il neocortex, la zona di corteccia cerebrale evolutivamente più recente. Una volta arrivati a destinazione, i nuovi neuroni vengono inseriti, attraverso i loro assoni e dendriti, nella rete neurale pre-esistente. Questo meccanismo contribuisce in maniera fondamentale alla plasticità neurale visto che aumenta il numero di “alberi” collegabili nelle varie reti neurali locali attraverso la plasticità sinaptica. L’ippocampo è una specie di centralina che si occupa di smistare le informazioni in arrivo ed è la regione protagonista quando si parla di memoria e apprendimento. La neurogenesi adulta, che qui ha origine, è quindi un potente elemento modulatore nei processi di apprendimento.
Conclusioni
La neurogenesi adulta è un fenomeno dipendente sia da fattori genetici sia dalle esperienze dell’individuo e dai fattori ambientali e biologici. Si tratta quindi di un processo altamente influenzato da fattori intrinseci ed estrinseci come fattori di crescita neuronali, antidepressivi, oppioidi, attività fisica, glucocorticoidi, ormoni sessuali, apprendimento, stress e persino la dieta.
La neurogenesi dell’adulto è un processo composto da più passaggi mediante i quali i neuroni vengono generati dalla divisione delle cellule staminali neurali adulte e migrano per essere integrati nei circuiti neuronali esistenti. Le alterazioni in uno qualsiasi di questi passaggi compromettono la neurogenesi e possono compromettere la funzione cerebrale, portando a deterioramento cognitivo e malattie neurodegenerative. La scoperta di neurogenesi adulta in zone del cervello fortemente colpite dal morbo di Parkinson, fa pensare a promettenti miglioramenti nelle terapie per questa o altre malattie neurodegenerative. Nei pazienti affetti da Alzheimer è comune notare una riduzione nel tasso di neurogenesi, cosa che contribuisce ad aggravare i sintomi, dovuti, tra l’altro, alla progressiva diminuzione della massa corticale. Pertanto, la comprensione dei meccanismi cellulari e molecolari che modulano la neurogenesi dell’adulto è al centro dell’attenzione della ricerca rigenerativa.
Fonti
- Involvement of transposable elements in neurogenesis – PubMed (nih.gov)
- Riusciremo un giorno a rigenerare il cervello? | Fondazione Umberto Veronesi (fondazioneveronesi.it)
- An Overview of Adult Neurogenesis – PubMed (nih.gov)
Fonti immagini
- Immagine in evidenza: ‘Il cervello continua a produrre neuroni fino a 90 anni’ | laRegione.ch
- Figura 1: “Biologia dello sviluppo” Zanichelli / Scott F.Gilbert, Michael J.F Barresi]
- Figura 2: Retrotransposon-induced mosaicism in the neural genome – PubMed (nih.gov)