Scoperta e caratterizzazione
Nel 1889, il batterio Clostridium tetani fu isolato in coltura pura grazie ad una procedura ideata sia da Shibasaburo Kitasato presso l’Istituto di Igiene dell’Università di Berlino (diretto da Robert Koch), sia da Guido Tizzoni e Giuseppina Cattani a Bologna. Nel 1890 gli stessi Tizzoni e Cattani, contemporaneamente a Knut Faber in Danimarca, scoprirono la tossina prodotta dal Clostridium tetani e responsabile del tetano. Il 4 giugno 1890 sulla rivista La Riforma Medica, Guido Tizzoni e Giuseppina Cattani pubblicarono il loro primo articolo nel quale dimostrarono la presenza della tossina tetanica e descrissero la sua purificazione. Faber, invece, pubblicò il suo lavoro principale sulla tossina tetanica nell’agosto 1890.
Un’altra tossina prodotta dallo stesso batterio Clostridium tetani fu identificata per la prima volta da Paul Ehrlich, e fu chiamata tetanolisina per la sua capacità di provocare l’emolisi.
Il Clostridium tetani produce, quindi, due tipi di tossine in condizioni favorevoli: la tetanolisina e la tetanospasmina (o neurotossina tetanica, TeNT). La prima non ha un ruolo patogenetico chiaro, mentre la seconda è la responsabile del tipico quadro clinico del tetano.
L’identificazione della neurotossina tetanica ha portato allo sviluppo di vaccini efficaci, e l’immunizzazione ha ora in gran parte eliminato il tetano dai paesi sviluppati.
Struttura molecolare
Tizzoni e Cattani iniziarono con le prime prove sperimentali per determinare le caratteristiche chimico-fisiche della neurotossina tetanica. I loro studi lasciarono pochi dubbi sulla natura proteica della tetanospasmina.
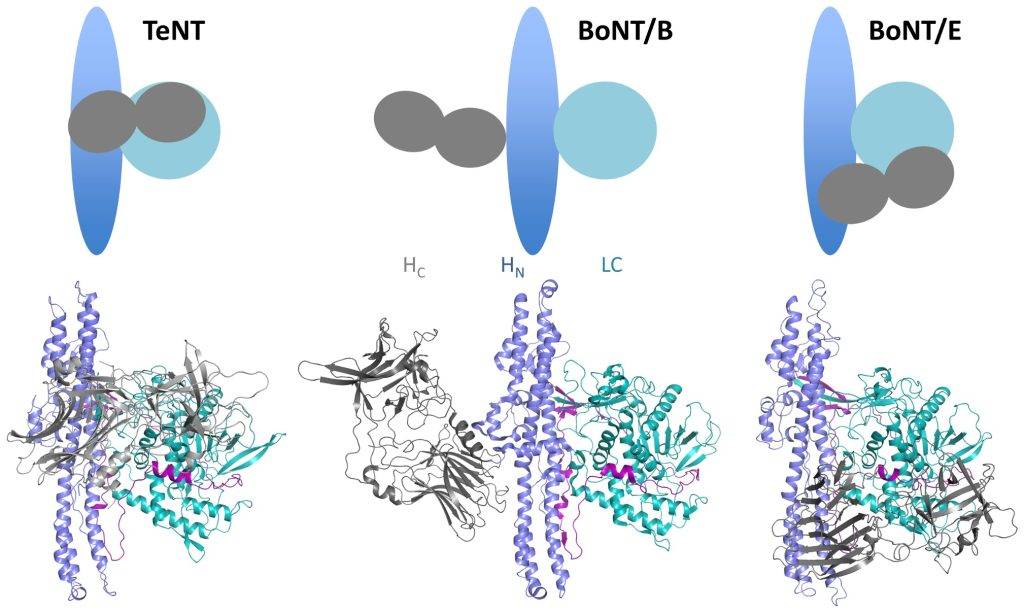
Oggi sappiamo che la neurotossina tetanica è costituita inizialmente da una singola catena polipeptidica di peso molecolare pari a 150 kDa. Dopo la scissione proteolitica, la neurotossina attiva è costituita da una catena amminoacidica pesante di 100 kDa e da una catena leggera (LC) di 50 kDa, legate tra loro da un ponte disolfuro. In particolare, la catena pesante è costituita da due domini di 50 kDa ciascuno: H N e H C.
La struttura cristallina rivela una disposizione conformazionale unica con interazioni significative tra i tre domini presenti: LC, H N e H C. Tale conformazione, inoltre, è molto diversa dalle neurotossine botuliniche (Fig. 1).
Via biosintetica
Il batterio Clostridium tetani si trova nell’ambiente e contamina le ferite dell’organismo ospite. La germinazione delle spore e lo sviluppo delle forme vegetative del Clostridium tetani, in condizioni di anaerobiosi, producono la tetanospasmina. Lo sviluppo di questa neurotossina nell’organismo ospite è favorito dalla presenza di:
- Tessuto necrotico.
- Sali di calcio.
- Associazione con infezioni da piogeni.
Funzioni biologiche
La tetanospasmina è una esotossina ed è una delle più tossiche conosciute dall’uomo, seconda solo alle neurotossine botuliniche (BoNT). Entrambe fanno parte della famiglia delle neurotossine clostridiali.
La tetanospasmina, però, differisce dalle altre neurotossine clostridiali per la sua capacità unica di colpire il Sistema Nervoso Centrale (SNC) mediante trasporto assonale retrogrado (trasporto dall’assone al corpo cellulare) all’interno dei motoneuroni.
Prima di entrare nel dettaglio del meccanismo d’azione della neurotossina, si consiglia la lettura dei nostri articoli sul tessuto nervoso e sull’organizzazione funzionale e strutturale del sistema nervoso.
Meccanismo d’azione
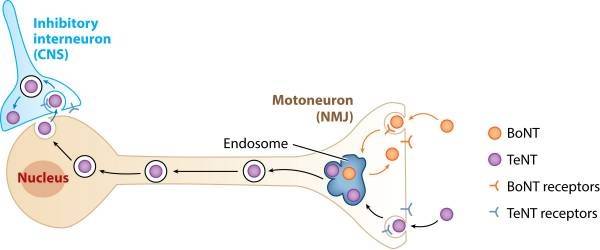
A seguito della sua produzione all’interno dell’organismo ospite, la neurotossina entra direttamente nel sistema circolatorio. Sulle membrane presinaptiche dei motoneuroni avviene la compartimentalizzazione nell’endosoma. Tramite trasporto retrogrado, la neurotossina viene condotta lungo l’assone del motoneurone fino ai corpi cellulari di questi neuroni motori. Raggiunge così gli interneuroni inibitori del Sistema Nervoso Centrale (SNC) tramite transcitosi, e qui viene rilasciata la catena leggera (LC) della neurotossina (Fig. 2).
A livello degli interneuroni inibitori, LC agisce scindendo un insieme specifico di proteine note come SNARE neuronali. La scissione di queste proteine da parte di LC previene la formazione del complesso SNARE, e provoca l’inibizione della neurotrasmissione.
Le proteine SNARE, in condizioni normali, si associano e agiscono per il rilascio dei neurotrasmettitori inibitori. Questi ultimi generalmente sono acido γ-amminobutirrico (GABA) e glicina. Il rilascio di glicina, blocca la liberazione di acetilcolina da parte dei motoneuroni e inibisce la contrazione, permettendo il rilassamento delle fibre muscolari. La presenza della neurotossina a livello degli interneuroni inibitori blocca il rilascio di glicina e, di conseguenza, si osserva un rilascio continuo di acetilcolina da parte dei motoneuroni, che porta a sua volta ad una contrazione muscolare incontrollata. L’esito è una paralisi spastica con il muscolo colpito costantemente contratto.
Flessibilità della struttura della tossina tetanica
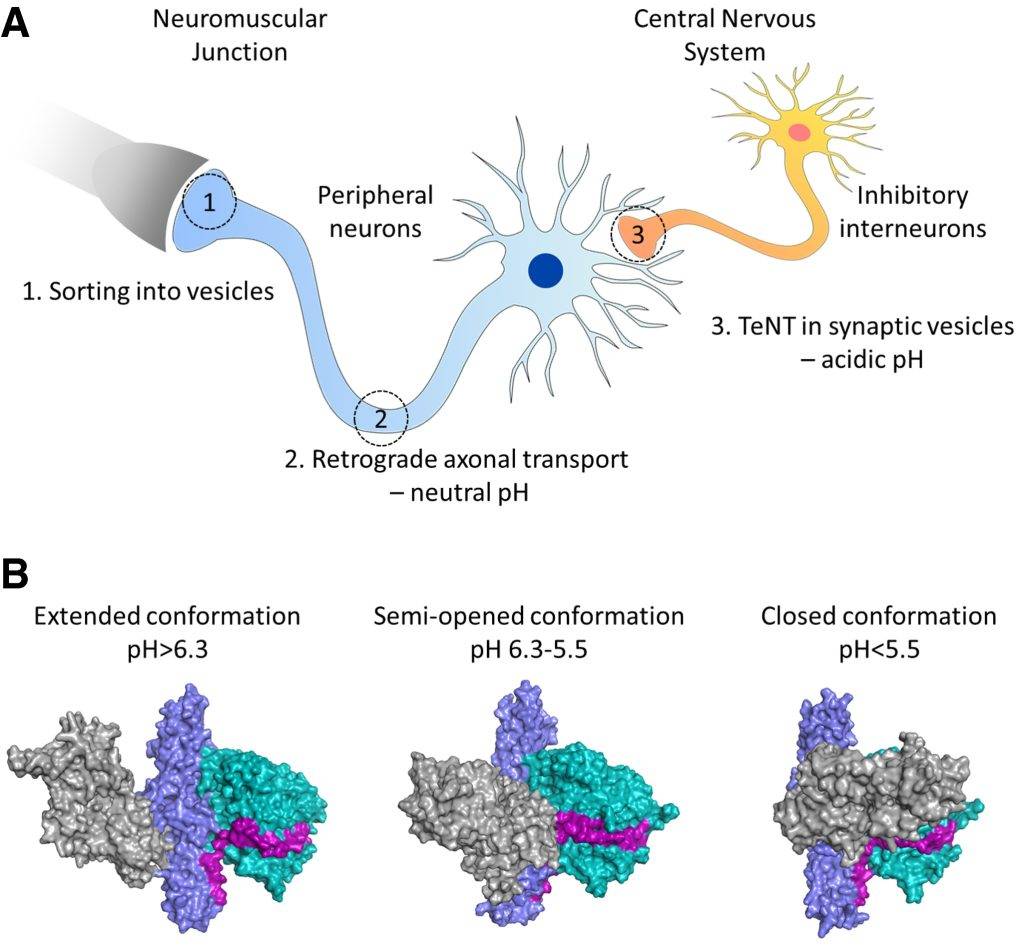
Uno studio recente (2017) approfondisce le diverse conformazioni della struttura della neurotossina tetanica dipendenti dal pH. Un ambiente neutro promuove la conformazione estesa della neurotossina, come riportato nello studio. Inoltre, dopo la transcitosi negli interneuroni inibitori, il pH diventa acido e la neurotossina tetanica adotta la sua configurazione chiusa (Fig. 3). Il fatto che TeNT possa presentare molteplici conformazioni ha importanti conseguenze sulla sua funzione, con una chiara distinzione dalle neurotossine botuliniche.
Infine, i risultati presentati suggeriscono che la flessibilità dei domini della neurotossina tetanica sia un prerequisito per la compartimentazione della tossina negli endosomi per il traffico neuronale.
Trattamento terapeutico del tetano e prevenzione
I pazienti che manifestano i sintomi del tetano devono essere trattati con una terapia di supporto (come miorilassanti, sedativi e ventilazione assistita), per controllare l’effetto della paralisi. Inoltre è necessaria una pulizia approfondita delle eventuali ferite presenti, poiché i tessuti sporchi e morti promuovono la crescita del Clostridium tetani.
Alcune volte i pazienti vengono trattati con alte dosi di antitossina per via endovenosa, così da cercare di neutralizzare la tossina che non si è ancora legata al tessuto nervoso. Tuttavia, l’efficacia terapeutica dell’antitossina è dubbia, eccetto che nel caso di tetano neonatale.
La penicillina, invece, inibisce fortemente la crescita del Clostridium tetani e blocca l’ulteriore produzione di tossina.
Infine, l’esito ottenuto con la terapia non è soddisfacente. Per questo motivo, la prevenzione è la migliore arma contro il tetano. Il vaccino contiene l’anatossina (o tossoide) tetanica, ottenuta detossificando la tossina con formalina, che mantiene la capacità di stimolare la produzione di anticorpi protettivi. Per il vaccino viene usata l’anatossina assorbita a sali di alluminio.
Immagini
Fonti
- Treccani.it
- Jawetz, Melnick, Adelberg’s Microbiologia Medica XXVII Edizione. Piccin Nuova Libraria s.p.a. ISBN 978-88-299-2872-9.
- Geoffrey Masuyer, Giuliano Corrado, Pål Stenmark “The structure of the tetanus toxin reveals pH-mediated domain dynamics”, 2017. PMID: 28645943.
- Min Dong, Geoffrey Masuyer, and Pål Stenmark “Botulinum and Tetanus Neurotoxins” 2018. PMID: 30388027.
Crediti delle immagini
- Immagine in evidenza: Flickr.com
- Figura1: Geoffrey Masuyer, Giuliano Corrado, Pål Stenmark “The structure of the tetanus toxin reveals pH-mediated domain dynamics”, 2017. PMID: 28645943.
- Figura2: Min Dong, Geoffrey Masuyer, and Pål Stenmark “Botulinum and Tetanus Neurotoxins” 2018. PMID: 30388027.
- Figura3: Geoffrey Masuyer, Giuliano Corrado, Pål Stenmark “The structure of the tetanus toxin reveals pH-mediated domain dynamics”, 2017. PMID: 28645943.