Caratteristiche
Paragonimus westermani è un verme piatto (platelminta) parassita appartenente alla classe dei Trematodi e alla sottoclasse dei digenei (o distomidi), responsabile della malattia polmonare chiamata paragonimiasi, conosciuta anche come distomatosi polmonare, emottisi endemica o emottisi parassitaria. Si tratta di una zoonosi che si riscontra solitamente in mammiferi selvatici (roditori, scimmie, felini) e domestici (cani, gatti, maiali), ma che può colpire anche l’essere umano.
Il verme adulto (Fig. 1) ha una forma simile a un chicco di caffè, una lunghezza che va da 7 a 16 mm, è largo da 4 a 8 mm, e ha il tegumento ricoperto di spine simili a scaglie. Come gli altri platelminti digenei, P. westermani è dotato di due ventose fornite di muscolatura radiale – una circoscrive l’apertura orale, l’altra è connessa all’apparato riproduttore e permette il rilascio delle uova – è ermafrodita, non possiede gli apparati respiratorio e circolatorio, presenta dei sistemi nervoso, escretore e digerente alquanto elementari, è eteroxeno (completa il ciclo vitale in più organismi ospiti) e si riproduce sia in maniera sessuata (nello stadio adulto) che in maniera asessuata (nello stadio larvale).
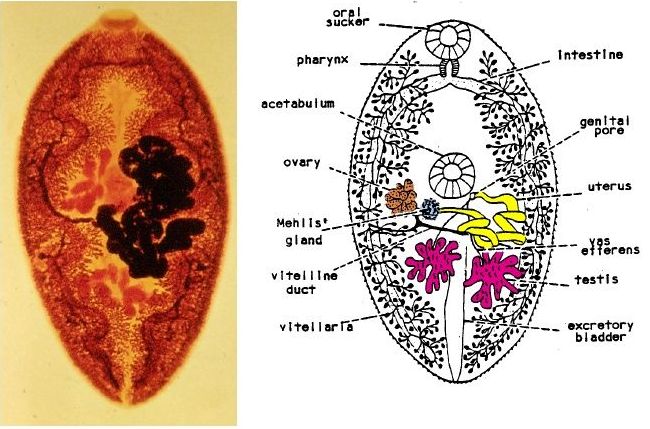
Questo platelminta è stato scoperto per la prima volta nel 1878, quando Pieter Westerman, il custode dello zoo di Amsterdam, notò la presenza del parassita in una tigre del Bengala morta di paragonimiasi. Dal suo nome deriva la denominazione della specie westermani.
Nel 1879, a Taiwan, durante un’autopsia venne scoperto il verme adulto nei polmoni di un uomo. A prescindere da queste due scoperte, nel 1880 sir Patrick Manson e Erwin von Baelz identificarono le uova di Paragonimus nell’espettorato di pazienti affetti, e Manson ipotizzò che l’ospite intermedio di questo verme fosse un mollusco. Circa una quarantina di anni dopo, tra il 1916 e il 1922, degli scienziati giapponesi (Koan Nakagawa, Sadamu Yokogawa, Harujiro Kobayashi, e Keinosuke Miyairi) raffigurarono il ciclo vitale completo di Paragonimus nella lumaca Semisulcospira.
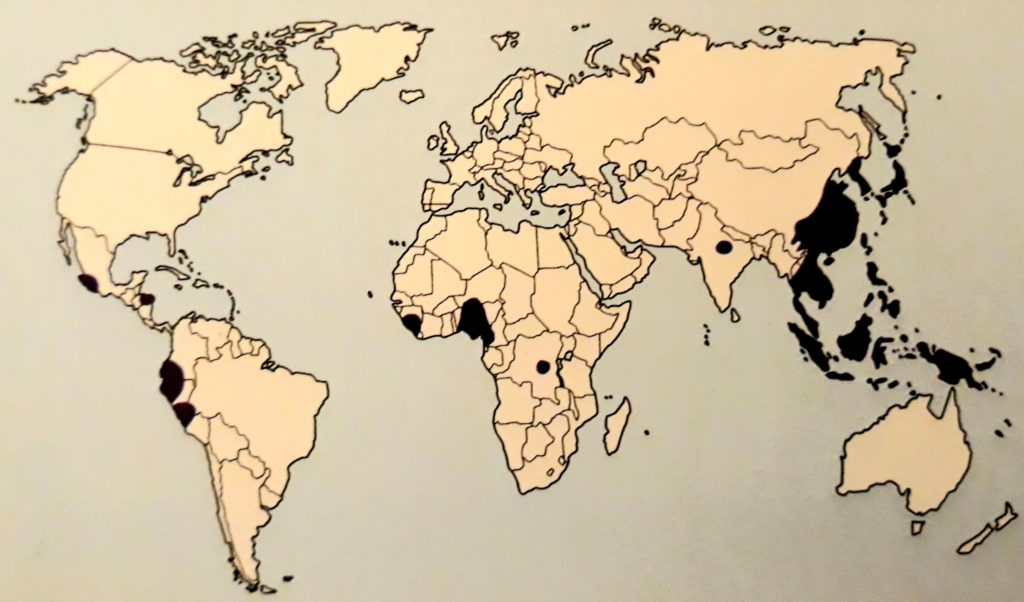
I vermi del genere Paragonimus sono diffusi soprattutto in alcuni stati dell’Asia (Cina, Corea, India, Filippine, Indonesia, Giappone, Vietnam, Thailandia e Corea del Sud), in alcuni territori dell’Africa centrale e occidentale (Camerun e Nigeria), e in alcune nazioni dell’America meridionale (Colombia, Perù, Venezuela ed Ecuador) (Fig. 2).
Filogenesi
| Dominio | Eukaryota |
| Regno | Animalia |
| Phylum | Platyhelminthes |
| Classe | Trematoda |
| Sottoclasse | Digenea |
| Ordine | Plagiorchiida |
| Famiglia | Paragonomidae |
| Genere | Paragonimus |
| Specie | P. westermani |
Ciclo vitale e patogenesi
Il ciclo di P. westermani inizia con il rilascio tramite l’escreato delle uova opercolate (Fig. 3), cioè dotate di opercolo (organo mobile che sigilla l’apertura da cui esce l’embrione) che ancora non contengono l’embrione (unembryonated eggs). Queste sono prodotte dai vermi adulti che vivono nei polmoni degli animali elencati all’inizio, compreso l’essere umano. In alternativa, le uova possono essere eliminate tramite le feci se dall’ipofaringe entrano nell’esofago.

Nell’ambiente esterno, le uova maturano e all’interno di esse si forma l’embrione (embryonated eggs); nel momento in cui entrano in contatto con l’acqua dolce, si dischiudono e liberano il miracidio (il primo stadio larvale), il quale cerca l’ospite ricettivo intermedio, cioè un mollusco gasteropode (chiocciola), nel quale penetra attraverso i tessuti molli. Qui comincia la riproduzione asessuata durante la quale il miracidio passa per tre fasi di sviluppo, ovvero sporociste, redia e cercaria (Fig. 4A). Al terzo stadio le larve abbandonano la chiocciola e si insinuano nei secondi ospiti intermedi, ovvero i crostacei (granchi o gamberi d’acqua dolce), dove maturano e diventano metacercarie infettanti (Fig. 4B), che risiedono nei muscoli dei crostacei all’interno di una parete cistica.
I mammiferi, gli ospiti definitivi, possono infettarsi mangiando crostacei crudi o poco cotti; quando le metacercarie vengono ingerite, arrivano nel duodeno, si escistano, trapassano la parete intestinale, entrano nella cavità peritoneale e, dopo aver bucato il diaframma, giungono nelle cavità pleuriche e infine ai polmoni. In questa sede si sviluppano i vermi adulti, che vivono anche fino a vent’anni avvolti da una capsula fibrosa generata da una reazione tissutale prima di tipo granulomatoso e dopo di tipo fibrotico, indotta dai cataboliti del parassita e dalle uova (Fig. 5); all’interno di questa capsula si accumula un liquido puruloide brunastro che sfocia in un bronchiolo.


Il ciclo appena descritto è raffigurato in maniera dettagliata in figura 6.

In seguito all’invasione dei vermi adulti, si verifica la comparsa dei sintomi della fase acuta della paragonimiasi, ossia febbricola, tosse spasmodica, malessere generale, emottisi, orticaria, splenomegalia, eosinofilia, diarrea, dolori addominali, dolori toracici spesso collegati a broncopolmonite, pleurite e pneumotorace.
Dopo un periodo di circa sei mesi avviene il passaggio verso la fase cronica della patologia, che inizia nel momento in cui l’infiammazione acuta si risolve, gli addensamenti si rimpiccioliscono e diventano piccole lesioni cistiche che attorniano il verme adulto. Esse racchiudono il parassita e un liquido marroncino (dove sono immerse le uova) che viene espulso verso l’esterno mediante l’espettorato grazie a dei collegamenti con i bronchi. In questa fase si hanno manifestazione come tosse secca con emissione di uno sputo giallo-brunastro, dolore toracico e dispnea. Quando il distoma muore (in seguito al trattamento o in modo naturale), la ciste sparisce e ciò che rimane sono strie fibrotiche o calcificazioni, che somigliano agli esiti di un granuloma tubercolare. È possibile assistere alla comparsa di episodi periodici di polmonite batterica ed emottisi grave. C’è da dire che il quadro clinico di questa fase viene spesso confuso con la tubercolosi.
A tal proposito è doveroso citare un articolo pubblicato su Lung India nel 2015 che descrive il caso di un ragazzo di 26 anni affetto da paragonimiasi polmonare che si sospettava fosse tubercolosi polmonare. Il paziente presentava emottisi rosso-nerastra ogni giorno (egli aveva quantificato fino a 15-20 ml al giorno), senza storia di febbre, dolore toracico, sincope, dolore addominale, dispnea parossistica notturna, oliguria, gonfiore generalizzato, dolore alle articolazioni, eritema o mal di gola. Si era sottoposto per un anno a un trattamento anti-tubercolare a causa di un’effusione pleurale tubercolare e una polisierosite eosinofilica.
Il giovane non fumava, occasionalmente beveva alcol, gli era capitato di mangiare granchi crudi o sott’aceto, il suo intestino e la sua vescica funzionavano normalmente, e non c’era alcuna storia di comportamenti ad alto rischio. L’esame fisico generale era nei limiti con un tasso di respirazione di venti respiri al minuto, all’esame sistemico il torace era bilateralmente simmetrico e le due parti, destra e sinistra, si muovevano nella stessa misura. Inoltre, nella sua famiglia non si erano mai verificati episodi di tubercolosi, ma solo di asma bronchiale.
Le analisi del sangue rivelarono 15,2 mg/dl di emoglobina, conta leucocitaria elevata a 18200/μl, 12% di eosinofili e conta piastrinica normale. La ricerca di bacilli alcol-acido resistenti nell’espettorato risultò negativa per tre giorni consecutivi, come anche il test di Mantoux. In aggiunta a ciò, nell’escreato non erano presenti eosinofili. La spirometria mostrò una tenue restrizione, l’analisi del torace ai raggi X e la tomografia computerizzata diedero come risultato fibrosi con bronchiectasia da trazione nella parte più alta del lobo sinistro, pochi discreti noduli in entrambi i lobi, linfadenopatia mediastinica, effusione delle pleure e un leggero ispessimento della pleura sinistra. Dopo la broncoscopia a fibre ottiche, l’analisi dell’espettorato mostrò uova opercolate di P. westermani.
A volte può capitare che i vermi adulti raggiungano ulteriori organi e tessuti come cervello e muscoli striati, e quando ciò avviene il ciclo vitale del parassita non può essere completato, in quanto le uova depositate non sopravvivono in questi siti. In ogni caso, la presenza del parassita in altre sedi, può comportare le forme extra-polmonari della paragonimiasi:
- Encefalica, che è frequente nei bambini. La fase acuta può simulare una meningo-encefalite e dura 1-2 mesi, mentre nella fase cronica la presenza di cisti intraparenchimali (che agiscono come lesioni che invadono lo spazio) provoca ipertensione endocranica, cefalea, vomito, convulsioni, emiplegia, paraplegia, ipostenia, paralisi dei nervi cranici e difetti della visione;
- Addominale, contraddistinta dalla genesi di granulomi e ascessi nella parete intestinale, nel fegato, nella milza, nella cavità peritoneale, nei linfonodi mesenterici e nel tessuto sottocutaneo della parete addominale. I sintomi sono diarrea con sangue e dolore addominale, oppure si possono avere delle masse palpabili, migranti o fisse.
Metodi di identificazione
La diagnosi della paragonimiasi si fonda principalmente sulla ricerca delle uova nell’espettorato, nelle feci, nel liquidi cerebrospinale e nel liquido pleurico. Al microscopio ottico si nota che le uova di P. westermani sono opercolate e presentano un maggiore spessore del guscio nel polo opposto all’opercolo, e tra l’altro non racchiudono l’embrione. Esiste una probabilità del 25% di individuare le uova nell’escreato, e per tale ragione è consigliata l’analisi microscopica di almeno sette campioni. Per quanto concerne l’esame copro-parassitologico, è adeguato nei bambini, dal momento ingoiano le uova del parassita con maggiore frequenza. La diagnosi microscopica può essere eseguita anche su campioni bioptici polmonari, cerebrali, sottocutanei, nei noduli intra-addominali o nelle lesioni cistiche.
Poiché l’indagine microscopica ha una bassa sensibilità, è opportuno utilizzare gli esami sierologici. Uno di questi è la metodica ELISA (enzyme-linked immunosorbent assay), che è specifica e sensibile, però è meno adatta per il monitoraggio della terapia, in quanto il titolo anticorpale, dopo un trattamento idoneo, si abbassa in un lasso di tempo abbastanza lungo, anche due anni. Per il follow-up è più vantaggioso il test di fissazione del complemento.
Un ulteriore approccio diagnostico è lo studio del polmone mediante tomografia computerizzata (TC), che, durante la fase acuta, consente di discernere addensamenti polmonari, strie opache collegate alla pleura (che coincidono con i percorsi dei vermi), versamenti e ispessimenti pleurici, falde di pneumotorace. In fase cronica si ravvisano le formazioni cistiche, che si collocano nelle aree periferiche, subpleuriche, del polmone, e hanno dimensioni da 0,5 a 4 cm. Con questo tipo di esame è possibile distinguere le lesioni recenti da quelle remote in base alle loro caratteristiche: le prime presentano una componente perilesionale emorragica che ha l’aspetto di un alone, mentre le seconde sono distinte da una parete fibrotica o calcificata, il cui spessore è direttamente proporzionale alla vecchiezza della lesione.
Comunque il versamento pleurico e il pneumotorace si possono verificare anche nella fase cronica con il tipico reperto “anello d’ombra”, ossia la lesione cistica con pareti fini che delimita un’opacità “a mezzaluna”; questa forma l’immagine “a eclissi solare”, che è dovuta al verme adeso alla parete interna della ciste. Se le cisti non contengono il verme, creano degli aggregati a “bolle di sapone”.
Per l’indagine delle forme cerebrali, le metodiche impiegate sono la TC e l’imaging a risonanza magnetica (MRI), che permettono di osservare in fase acuta un agglomerato di noduli granulomatosi (con aspetto a grappolo) con edema perilesionale. Hanno dimensioni che vanno da 1 a 5-10 cm, si piazzano normalmente negli emisferi cerebrali (occipitale, parietale posteriore o temporale posteriore) e di rado compromettono i componenti del rombencefalo, cioè il cervelletto e il midollo allungato.
Terapia e profilassi
Per la cura della paragonimiasi, il farmaco utilizzato è il Praziquantel (Biltricide), somministrato per via orale con un dosaggio di 25 mg/kg tre volte al giorno per due giorni, a intervalli di non meno di quattro ore e di non più di sei ore. Il meccanismo d’azione del Praziquantel consiste nel provocare la vacuolizzazione del tegumento del verme, distruggendone l’integrità. Può essere preso tranquillamente in gravidanza, ma non è consigliato durante l’allattamento, in quanto compare nel latte materno.
Un ulteriore farmaco è il Triclabendazolo (Egaten) alla dose di 10 mg/kg, a somministrazione orale una volta dopo i pasti; oppure, se l’infezione è più grave, si raccomandano due dosi di 10 mg/kg, sempre dopo i pasti e a distanza di dodici ore. Questo farmaco agisce legando la beta-tubulina con conseguente blocco della polimerizzazione.
Per le forme cerebrali, il trattamento si basa sull’uso di corticosteroidi insieme al Praziquantel, allo scopo di ridurre la risposta infiammatoria indotta dai vermi morenti.
Per quanto concerne la profilassi, il modo migliore per evitare di venire a contatto con P. westermani è quello di cuocere completamente i crostacei prima di gustarli.
Fonti
- Gabriella Cancrini. 2013. “Parassitologia e tecniche di laboratorio”, Lombardo Editore
- Desowitz, R. 1987. “New Guinea Tapeworms and Jewish Grandmothers: Tales of Parasites and People”
- Francis E. G. Cox. 1996. “The wellcome trust illustrated history of tropical diseases”, The Wellcome Trust, London, United Kingdom
- Manson, P. “Distoma ringeri”, Med. Times Gaz. 1881
- Grove, D. I. 1990. “A history of human helminthology”, CAB International, Wallingford, United Kingdom
- Gordon G. Cook. 1998. Manson’s Tropical Diseases”, 12th edizione Saunders
- Philip E. S. Palmer, Maurice M Reeder, 2001. “The Imaging of Tropical Diseases: with epidemiological, pathological and clinical correlation”, Springer Verlag
- John Bennett, Raphael Dolin, Martin J. Blaser. 2005. “Principles and practice of infectious diseases”, 6th edizione Elsevier Churchill Livingstone
- Shivani Kalhan, Pankaj Sharma, Sonia Sharma, Neha Kakria, Sharmila Dudani and Anshu Gupta. 2015. “Paragonimus westermani infection in lung: A confounding diagnostic entity”, Lung India
- Soon-Hyung Lee, Ho-Jin Park, Sung-Jong Hong, Jong-Yil Chai and Sung-Tae Hong. 1987. “In vivo effects of praziquantel on Paragonimus westermani by light and scanning electron microscopic observation”, The Korean Journal of Parasitology
- https://web.stanford.edu/group/parasites/ParaSites2009/FatimaHassan_Paragonimus/FatimaHassan_Paragonimus%20westermani.htm
- https://www.merckmanuals.com/professional/infectious-diseases/trematodes-flukes/paragonimiasis
- https://www.askjpc.org/vspo/show_page.php?id=RTFVNEh0Y3VNT1NHL1NsZ0pJd1VYZz09
- https://www.cdc.gov/dpdx/paragonimiasis/index.html
- https://www.cdc.gov/parasites/paragonimus/
- https://slideplayer.com/slide/4259369/
- https://crocodilusdaratensis.wordpress.com/2010/08/17/paragonimus-westermani/
- https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/018714s013lbl.pdf