I Mitocondri sono organuli cellulari essenziali nel metabolismo, e per questo sono considerati una vera e propria centrale energetica della cellula, con la produzione di ATP. Oltre a questo ruolo, i mitocondri regolano altri processi fisiologici, tra cui l’apoptosi, la produzione di ROS (intermedi reattivi dell’ossigeno) e l’omeostasi del calcio.
Il DNA mitocondriale produce una classe di peptidi, che mediano la risposta allo stress cellulare interagendo con il DNA nucleare, i cosiddetti MDPs (mitochondria-derived peptides) (Fig. 1). A questo gruppo appartiene l’Humanina, una piccola proteina che gioca un ruolo protettivo in molte patologie, come diabete, malattie neurodegenerative ed eventi cardiovascolari, ed è fortemente associata alla longevità.
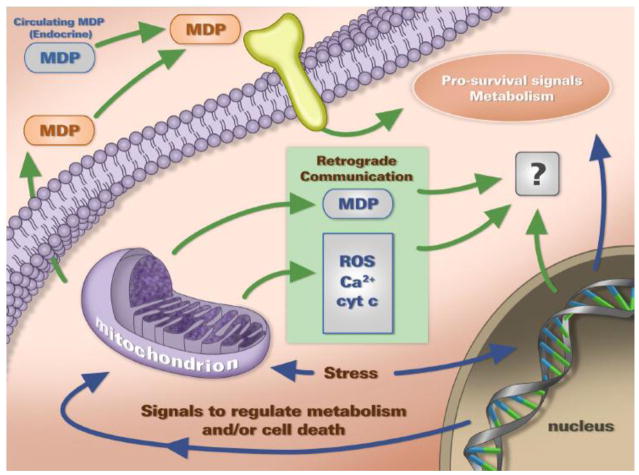
Struttura ed espressione
Ad oggi, sono stati identificati otto MDPs, che sono codificati da brevi sequenze ORF (open reading frame), presenti all’interno di alcuni geni del DNA mitocondriale. L’Humanina fu identificata per la prima volta nel 2001 da Hashimoto e colleghi, nel cervello di un uomo affetto da Alzheimer. È una proteina altamente conservata nel corso dell’evoluzione, ed è codificata da una ORF localizzata all’interno del gene MTRNR2 (Fig. 2), che esprime l’RNA ribosomale 16S. L’Humanina è presente in due isoforme, una di 21 e l’altra di 24 aminoacidi, sintetizzate rispettivamente nei mitocondri e nel citosol.
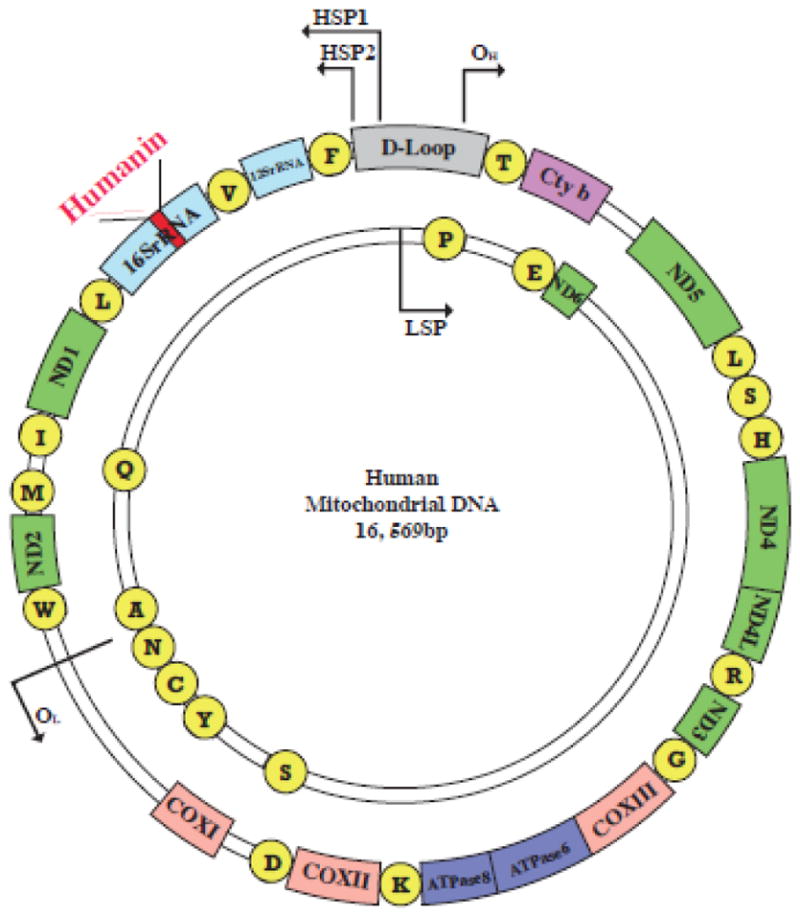
La struttura secondaria prevede domini a β-foglietto (tra gli amminoacidi in posizione 6 e 14) e ad α-elica (tra le posizioni 19 e 24). I residui amminoacidici dalla posizione 3 alla 19 compongono il “Core Domain”, e studi di mutagenesi hanno rivelato che questi sono essenziali per l’attività e la regolazione della proteina.
L’Humanina è espressa ampiamente in diversi tessuti ed organi tra cui il cuore, il rene, il fegato, i testicoli, il muscolo scheletrico e il cervello, dove esercita un potente effetto citoprotettivo e antiossidante
Ruolo dell’humanina nella segnalazione cellulare
L’Humanina può trovarsi o in forma secreta nel plasma, oppure può agire a livello cellulare, dove esplica le sue funzioni. È stato dimostrato che essa agisce come ligando per due differenti recettori di membrana: FPRL1, accoppiato a proteine G, e il recettore trimerico CNTFR/WSX-1/gp130 (Fig. 3).
Legandosi al recettore FPRL1, l’Humanina induce una rapida mobilizzazione del calcio intracellulare e l’attivazione della via di ERK1/2 (via di segnalazione implicata nella sopravvivenza cellulare), che è responsabile dei suoi effetti citoprotettivi sulle cellule nervose.
Il recettore CNTFR/WSX-1/gp130 invece, è composto da tre proteine:
- gp130: è una glicoproteina che appartiene alla famiglia dei recettori dell’interleuchina-6 ed è coinvolta nell’attivazione della via di JAK/STAT, pathway che media la proliferazione cellulare e la risposta infiammatoria.
- CNTFR (fattore neurotrofico ciliare): modula il differenziamento e l’espressione genica, contribuendo al ruolo neuroprotettivo dell’Humanina. Topi carenti di questa proteina mostrano una precoce insorgenza di patologie neurodegenerative, tra cui l’Alzheimer.
- WSX-1: corecettore che regola il segnale di JAK/STAT. Nei neuroni, l’overespressione di WSX-1 induce un incremento dell’attività dell’Humanina, mentre il silenziamento abolisce la formazione del complesso recettoriale.

L’ Humanina è modulata anche da un altra proteina, il fattore di crescita insulino-simile di tipo 1 (IGF-1). Il pathway di IGF-1 è essenziale nel metabolismo e nella senescenza cellulare; attiva la via antiapoptotica di PI3K/Akt e inibisce a livello mitocondriale proteine pro-apoptotiche come BID e BAX.
Inoltre, sia IGF-1 che l’Humanina sono regolati a livello endocrino (Fig. 4) dal GH (ormone della crescita). Il GH, prodotto dall’ipofisi sotto lo stimolo del GHRH (ormone di rilascio del GH), agisce su IGF-1 e reprime indirettamente l’attività dell’Humanina, diminuendone drasticamente i livelli plasmatici.

Correlazione con l’Alzheimer
Come detto precedentemente, l’Humanina fu identificata per la prima volta nel tessuto cerebrale di un individuo affetto da Alzheimer, quindi non è sorprendente che l’Humanina svolga una ruolo centrale nella patologia.
L’Alzheimer è una patologia neurodegenerativa causata dall’alterazione del metabolismo di una proteina, la APP (precursore della β-amiloide). L’errato clivaggio della APP causa l’accumulo di β-amiloide, che inibisce la trasmissione nervosa e induce la progressiva distruzione neuronale, portando all’atrofia cerebrale.
Uno dei primi studi condotti in vitro dimostrò che l’Humanina preserva le cellule nervose in coltura dall’apoptosi indotta dalla proteina β-amiloide e anche da altre proteine mutate, come presenilina 1 e presenilina 2. Si è visto sperimentalmente che l’Humanina è in grado di interagire direttamente con gli aggregati Aβ-amiloidi, cambiandone la morfologia e accelerandone la degradazione in vitro.
Il primo studio effettuato in vivo su cavie murine esaminò la funzionalità dell’Humanina utilizzando la scopolamina, un farmaco allucinogeno antagonista dei recettori muscarinici, che causa perdita di memoria simile a quella riscontrata nei pazienti affetti da Alzheimer. Iniezioni ripetute di una versione ricombinante di Humanina (HNG) migliorarono sensibilmente la memoria a breve termine dei topi malati rispetto a quelli di controllo.
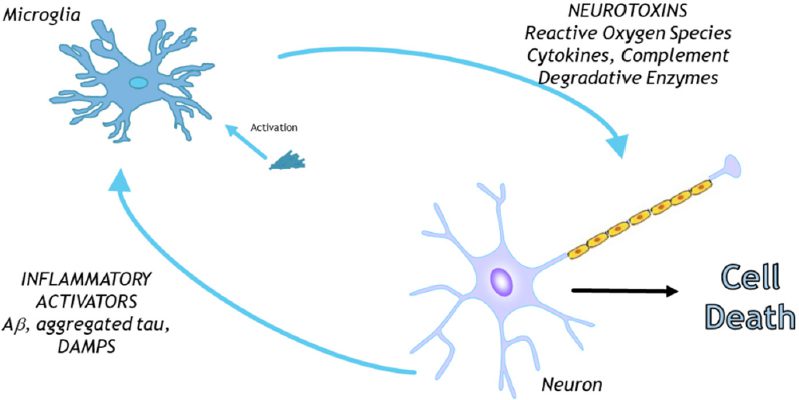
Un altro studio rivelò che in topi trattati con Aβ 25–35 la somministrazione di alte dosi di Humanina era anche in grado di ridurre la risposta infiammatoria. Si osservava una netta diminuzione dei livelli di molecole pro-infiammatorie, come interleuchina-6 e TNF-α, e dell’attività delle cellule della microglia (cellule cerebrali con funzioni immunitarie) (Fig. 5), iperattive nella patologia.
Correlazione con l’ischemia e la malattie cardiovascolari
L’Humina è fortemente associata con lo stress ossidativo, che contribuisce all’insorgenza delle patologie cardiovascolari, tra cui infarto del miocardio e ictus ischemico.
Evidenze scientifiche dimostrano come l’Humanina sia in grado di proteggere cellule gangliari di ratto in coltura dall’ipossia indotta dal cloruro di cobalto (CoCl2). Dopo un trattamento con HNG, le cellule aumentano l’attività metabolica e i livelli citoplasmatici di ATP.
Nell’ictus ischemico sia l’Humanina che IGF-1 svolgono un ruolo funzionale, proteggendo le cellule nervose dall’ipossia.
In uno studio in cui i topi transgenici vengono alimentati con una dieta ad alto contenuto di grassi, entrambi risultano contribuire alla riduzione delle placche aterosclerotiche, confermando una spiccata attività antiossidante e antinfiammatoria sulle cellule endoteliali.
Inoltre, in topi a cui era stata occlusa sperimentalmente l’arteria cerebrale media per 75 minuti, l’iniezione di HNG riduceva del 50% il volume del tessuto infartuato, determinando una progressiva ripresa dei livelli di ossigenazione.
Come nell’ictus ischemico, il piccolo peptide è anche in grado di riprogrammare le normali funzioni e il metabolismo delle cellule endoteliali coronariche nel corso dell’infarto del miocardio.
Correlazione con il diabete
L’Humanina sembra anche essere correlata a diversi disordini metabolici, tra cui il diabete mellito di tipo 1 e 2. In quello di tipo 1 (di eziologia soprattutto autoimmune) la distruzione della β-cellula da parte di macrofagi e linfociti T è dovuta all’attività di varie molecole pro-infiammatorie, tra cui Interleuchina-1 (IL-1), TNF-α e Interferone-gamma (IFN-γ). L’Humanina induce un effetto anti-apoptotico su queste cellule, ripristinando la tolleranza al glucosio.
Nel diabete di tipo 2 invece, l’iperproduzione di ROS, dovuta all’iperglicemia, provoca la mobilitazione dell’Humanina dai vari tessuti alle β-cellule, promuovendo la biogenesi mitocondriale, e di conseguenza la produzione di insulina.
Una ricerca recente mette in relazione i livelli di Humanina nel siero di soggetti sani, prediabetici e diabetici. La concentrazione della proteina risulta più bassa nei soggetti diabetici ed è direttamente proporzionale alla percentuale di emoglobina glicata, una forma di emoglobina a cui si lega il glucosio ematico (è un marker diagnostico del diabete). Inoltre, nei soggetti pre-diabetici, i livelli di Humanina risultano diminuiti del 60%, segno del contributo della proteina nell’insorgenza della patologia.
Prospettive future
Ormai è certo che i mitocondri e gli MDPs giocano un ruolo centrale nella biologia della cellula. Attualmente, sono in corso vari studi e trial clinici che mirano alla realizzazione di farmaci che riescano a ripristinare in vivo le funzioni dell’Humanina in queste patologie. Tutto questo è possibile grazie alle tecnologie cellulari e alle scienze omiche, tra cui la proteomica e l’interattomica, che ci aiuteranno in futuro a decodificare questi enigmi affascinanti, che purtroppo, ad oggi, sono solo parzialmente risolti.
Fonti
- Cobb LJ, Lee C, Xiao J, Yen K, Wong RG, Nakamura HK, Mehta HH, Gao Q, Ashur C, Huffman DM, Wan J, Muzumdar R, Barzilai N, Cohen P. Naturally occurring mitochondrial-derived peptides are age-dependent regulators of apoptosis, insulin sensitivity, and inflammatory markers. Aging (Albany NY). 2016; 8:796–809. 10.18632/aging.100943 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Merry T. L., Chan A., Woodhead J. S. T., Reynolds J. C., Kumagai H., Kim S.-J., et al. (2020). Mitochondrial-Derived Peptides in Energy Metabolism. Am. J. Physiology-Endocrinology Metab. 319 (4), E659–E666. 10.1152/ajpendo.00249.2020 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- K.Yen, C.Lee, H.Metha, P.Cohen. The emerging role of Mitochondria-derived peptides humanin in stress resistance. HHS public access. 2013
- L.Rochette, A.Meloux, M.Zeller, Y.Cottin, C.Vergely., et al. Role of humanin in cardiovascular disorders. Elsevier. 2020
- S.Zhou, X.Hu, S.Bennett, J.Xu, Y.Mai. The molecular structure of humanin in neural and skeletal disease, and in tissue regulation. Frontiers in Cell and Development Biology. 2022.
- J.Xiao, SJ.Kim, P.Cohen, K.Yen. Humanin: functional interfaces with IGF-1. HHS Public Access. 2017
Crediti immagini
- Immagine in evidenza: https://www.focus.it/scienza/scienze/malattie-mitocondriali-ecco-che-cosa-sono
- Figura 1: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3641182/
- Figura 2: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4961574/?report=classic
- Figura 3: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3641182/
- Figura 4: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4961574/?report=classic
- Figura 5: https://nnjournal.net/article/view/3552