La malattia di Alzheimer (AD) è un tipo di demenza caratterizzata dalla degenerazione del tessuto cerebrale, che ne determina una conseguente perdita delle cellule nervose, e di conseguenza una progressiva riduzione dell’autonomia funzionale. L’AD è un disordine neurodegenerativo con esordio insidioso e progressiva compromissione delle funzioni cognitive e comportamentali, tra cui memoria, comprensione, linguaggio, attenzione e ragionamento.
Generalità sull’Alzheimer
Il termine demenza è un termine generico, che fa riferimento al declino delle capacità cognitive, abbastanza gravi da interferire con la vita quotidiana. Tra queste l’Alzheimer è il tipo più comune, rappresentando almeno i due terzi dei casi di demenza nelle persone di età pari o superiore a 65 anni.
Il morbo di Alzheimer fu descritto per la prima volta nel 1907 dallo psichiatra e neuropatologo Alois Alzheimer (Figura 1). Quest’ultimo, verso gli inizi del ‘900, assunse grande notorietà per via delle sue pubblicazioni riguardanti il cervello e le condizioni patologiche associate ad esso, quali l’arteriosclerosi cerebrale. In particolare, il merito della notorietà di Alzheimer si deve alla presentazione di un caso, durante la conferenza di Psichiatria di Tubingen, riguardante una donna di 51 anni, Auguste Deter, la prima paziente a cui venne diagnosticata quella che in seguito fu riconosciuta, poi, come malattia di Alzheimer.
Il caso della signora Deter
La signora Deter fu seguita con attenzione dal dottor Alzheimer, il quale sottolineò sintomi come perdita di memoria, disorientamento e allucinazioni, fino all’incapacità di qualsiasi forma di conversazione, per arrivare infine alla morte. Successivamente alla morte, lo psichiatra ottenne il permesso di eseguire un’autopsia sulla paziente ormai deceduta. Esaminando scrupolosamente ogni dettaglio cerebrale, osservò un’evidente atrofia della corteccia, e dalle analisi al microscopio, evidenziò la presenza di depositi anomali nel tessuto nervoso.
La Demenza Presenile
Solo più tardi, nel 1910, Emil Kraepelin, il più famoso psichiatra di lingua tedesca dell’epoca, ripubblicò il suo trattato “Psichiatria“, citando una nuova forma di demenza scoperta da Alois Alzheimer, chiamandola appunto “malattia di Alzheimer” o “Demenza Presenile”.
Nella caratterizzazione della malattia sembra che abbia avuto un ruolo chiave anche un giovane ricercatore italiano, Gaetano Perusini (1879-1915), a cui il neuropatologo Alzheimer affidò la continuazione della sua ricerca sulla strana forma di demenza.

Epidemiologia
Alzheimer nel mondo
A livello mondiale, secondo l’Organizzazione Mondiale della Sanità (OMS) si stima che i casi di demenza siano oltre 55 milioni, il 50-60% dei quali soffrano di Alzheimer. Secondo le Linee di Indirizzo Nazionali sui Percorsi Diagnostico Terapeutici Assistenziali per le demenze nei paesi industrializzati, la prevalenza della malattia di Alzheimer è di circa l’8% negli ultrasessantacinquenni e sale ad oltre il 20% dopo gli ottant’ anni.
L’OMS segnala, inoltre, che, nel 2010, soffrivano di demenza “solo” 35,6 milioni di persone, circa 20 milioni in meno rispetto agli oltre 55 milioni di oggi. Numero destinato ad aumentare nei prossimi anni, soprattutto nei paesi occidentali, fino a 78 milioni di persone affette da demenza entro il 2030 e addirittura a 139 milioni entro il 2050.
Alzheimer in Europa
La situazione in Europa non è migliore se si pensa che i casi di Alzheimer siano circa il 54% di tutte le demenze, con una prevalenza nella popolazione ultrasessantacinquenne del 4,4%.
Alzheimer in Italia
L’Italia è uno dei Paesi europei che presenta più anziani (persone con età uguale o superiore ai 65 anni) e quasi il 17% della popolazione, per un totale di 9,5 milioni, ha superato i 65 anni di età. Secondo l’Istituto Superiore di Sanità (ISS) attualmente l’Italia risulta ottava tra i paesi con il maggior numero di persone affette da demenze, con una stima di 1,4 milioni di malati, 600.000 dei quali colpiti da Morbo di Alzheimer, e circa 3 milioni sono le persone direttamente o indirettamente coinvolte nella loro assistenza, con conseguenze anche sul piano economico e organizzativo.
Le proiezioni demografiche prevedono che fra trent’anni avremo nel nostro Paese circa 280 anziani ogni 100 giovani, con aumento di tutte le malattie croniche legate all’età, e tra queste le demenze.
Patogenesi
Nello studio dell’AD una delle maggiori sfide nel campo medico-scientifico è chiarire l’eziopatogenesi della malattia al fine di sviluppare un trattamento specifico adeguato.
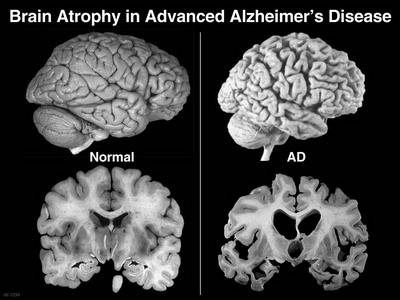
Mediante un esame diagnostico specifico, quale ad esempio risonanza magnetica, in soggetti affetti da AD è possibile osservare macroscopicamente, una marcata atrofia cerebrale dovuta ad una degenerazione dei neuroni. Questo ne determina un aumento dell’ampiezza dei solchi cerebrali ed un incremento del volume ventricolare (Figura 2), con la conseguenza di una diminuzione del peso e del volume dell’organo. Queste alterazioni macroscopiche coinvolgono le zone della corteccia temporale, parietale, frontale, l’ippocampo e l’amigdala. Queste sono aree coinvolte nei processi di memoria e di apprendimento, e sono riscontrabili anche in soggetti sani di età avanzata, in quanto sono espressione di un fisiologico invecchiamento cerebrale. Tuttavia nella malattia di Alzheimer queste alterazioni sono maggiormente evidenti e molto più distribuite.
Ipotesi amiloide nella degenerazione neuronale
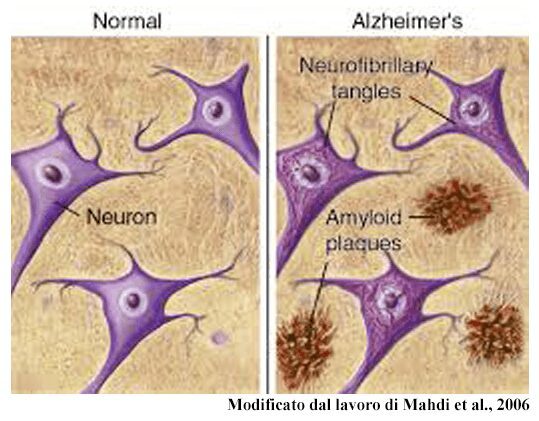
Secondo alcune ipotesi l’evento patogenetico chiave responsabile della degenerazione neuronale e delle modificazioni morfologiche, funzionali e cognitive tipiche dell’ Alzheimer è la comparsa di placche amiloidi o senili. Queste sono strutture di forma rotondeggiante presenti nel tessuto cerebrale di soggetti con Alzheimer, che si localizzano a livello extra-cellulare (Figura 3).
Amyloid Precursor Protein
Tali placche sono costituite da un peptide, denominato β-amiloide (Aβ), che deriva, per mezzo di un processo proteolitico, dalla proteina precursore dell’amiloide (Amyloid Precursor Protein o APP), ovvero una proteina transmembrana espressa in diverse cellule corporee, e in particolar modo nel Sistema Nervoso Centrale. Questa proteina possiede una porzione N-terminale, che si affaccia nello spazio extra-cellulare, e una porzione C-terminale che rappresenta il dominio intra-citoplasmatico della proteina. A livello dell’estremità C-terminale è presente una sequenza di amminoacidi chiamata β-amiloide (Aβ), in cui agiscono i tre principali enzimi coinvolti nel metabolismo dell’APP: α-secretasi, β-secretasi e γ-secretasi. In relazione all’attività di questi enzimi, l’APP può seguire due diverse vie di processazione, una amiloidogenica e l’altra non amiloidogenica.
La via amiloidogenica
In particolare, nella via amiloidogenica si ha l’azione combinata di enzimi β- e γ-secretasi, che determinano il rilascio di frammenti amiloidogenici, nello spazio extracellulare, dove possono accumularsi e formare strutture tossiche per i neuroni e per le sinapsi. La proteina β-amiloide è quindi un frammento derivato dal taglio della proteina APP ad opera di β-secretasi. Da ciò vengono generati frammenti di Aβ di diversa lunghezza, tra cui Aβ40 e Aβ42; in particolare quest’ultimo tende ad accumularsi in fibrille amiloidi, note come placche senili, in aree cerebrali come l’ippocampo, l’amigdala e la neocorteccia.
Nel soggetto affetto da malattia di Alzheimer si ha una condizione di disequilibrio tra la via amiloidogenica e la via non amiloidogenica, che non si verifica invece nel soggetto sano, in cui prevale una situazione di equilibrio tra le due vie di processazione.
Relazione tra il cromosoma 21 e la malattia di Alzheimer
Inoltre è stata scoperta una relazione tra il cromosoma 21 e la malattia di Alzheimer: il gene che codifica per la proteina APP risiede sul cromosoma 21, e la Sindrome di Down è un’anomalia cromosomica caratterizzata dalla presenza di una copia aggiuntiva del cromosoma 21. Per questo i pazienti affetti da sindrome di Down presentano un’eccessiva espressione della proteina APP. Seguendo questa linea, la maggior parte degli studi ha dimostrato che circa il 50% delle persone con sindrome di Down svilupperà il morbo di Alzheimer all’età di 60 anni.
Ipotesi proteina Tau
Altra caratteristica microscopica che, secondo la comunità scientifica, è responsabile della neurodegenerazione nella AD è l’iperfosforilazione della proteina Tau (pTau). Questa favorisce la formazione di aggregati neurofibrillari intracellulari. La Tau appartiene alla famiglia delle proteine associate ai microtubuli, ed è un importante elemento costitutivo del cosiddetto citoscheletro, fondamentale per il corretto funzionamento delle cellule nervose, e il trasporto di sostanze nutritive lungo l’assone.
L’iperfosforilazione della proteina Tau
Nei pazienti affetti da morbo di Alzheimer questa proteina risulta iperfosforilata, ovvero ha subito un’addizione di gruppi fosfato, impedendo il legame ai microtubuli, destabilizzandoli e determinando come conseguenza la degradazione del citoscheletro e la compromissione del trasporto assonale. L’iperfosforilazione favorisce la formazione di aggregati di fibrille della proteina Tau, i grovigli neurofibrillari, e di forme tossiche che conducono alla morte dei neuroni, nota come neurodegenerazione.

I grovigli neurofibrillari non sono disfunzioni tipiche della malattia d’Alzheimer, bensì essi sono stati trovati in altri disordini neurodegenerativi, e per tal motivo è stato coniato il termine generico di “Taupatie”.
Ipotesi infiammatoria
Negli ultimi anni si parla, inoltre, dell’ipotesi infiammatoria come attore chiave nella progressione dell’Alzheimer. La reazione infiammatoria, definita in questo caso con il termine “neuro-infiammazione”, caratterizza la maggior parte dei disordini neurodegenerativi e coinvolge l’attivazione del sistema immunitario. Come già accennato l’accumulo della proteina β-amiloide e l’iperfosforilazione della proteina Tau formano, rispettivamente, placche senili ed ammassi neurofibrillari. Queste alterazioni vengono identificate dal sistema immunitario, in particolare dalle cellule della microglia deputate alla “sorveglianza immunitaria”, come minaccia, provocando una reazione infiammatoria per neutralizzarle.
L’attivazione della microglia
In questo contesto l’attivazione della microglia assume un doppio ruolo: da una parte esercita un effetto neuro-protettivo contrastando l’amiloidosi e rimodellando le connessioni sinaptiche e per effetto di meccanismi di fagocitosi e di citotossicità, distruggono le placche e i detriti cellulari; dall’altra determina un eccessivo rilascio di fattori citotossici colpendo indistintamente anche i neuroni sani, sortendo effetti neurotossici e neurodegenerativi.
Il meccanismo alla base della formazione delle placche amiloidi e dei grovigli neurofibrillari non è ancora del tutto chiaro. Al momento l’unica certezza è che determinano danneggiamento e morte delle cellule nervose, provocando di conseguenza difficoltà di memoria ed alterazioni comportamentali.
Fattori di rischio dell’Alzheimer
Le cause della malattia d’Alzheimer sono ancora del tutto sconosciute. Ciò che si può dire di sicuro è che l’Alzheimer è una malattia di origine multifattoriale, in cui si ha la concomitanza di più fattori che predispongono ai processi patogenetici tipici della malattia e, quindi, al manifestarsi della stessa. I principali fattori di rischio possono essere distinti in modificabili e non modificabili.
Fattori non modificabili
Tra i non modificabili rientrano:
Età avanzata
Rappresenta il fattore di rischio più predisponente. La prevalenza della AD aumenta esponenzialmente a partire dai 60 anni, con valori che raddoppiano ogni circa 10 anni;
Fattori genetici
La maggior parte delle forme di AD vengono definite sporadiche (SAD), colpisce circa il 98% dei soggetti affetti da Alzheimer e si manifesta senza ereditarietà tra le generazioni di una stessa famiglia. Generalmente la forma sporadica esordisce oltre i 65 anni di età. In pochi casi l’Alzheimer si manifesta in età più giovanile, generalmente prima dei 60-65 anni, e più della metà di queste forme ad esordio precoce sono denominate familiari (FAD), la malattia cioè si manifesta in due o più persone appartenenti allo stesso nucleo familiare, dovuta a mutazioni di geni chiamati presenilina-1 (PSEN1), presenilina-2 (PSEN2) e proteina precursore di beta-amiloide (APP).
È stato definito, inoltre, un rischio di insorgenza della AD nei soggetti portatori di una particolare apolipoproteina (ApoE), prodotta da un gene specifico, localizzato nel cromosoma 19. Esistono tre tipi principali di tale proteina, ma una in particolare, l’ApoE4 (poco nota) aumenta la probabilità di ammalarsi di Alzheimer. Soltanto nel 50% dei malati di Alzheimer si trova la proteina ApoE4, e non tutti coloro che hanno tale proteina presentano la malattia;
Sesso femminile
Studi epidemiologici hanno osservato un rischio di sviluppare AD tra le donne quasi doppio rispetto agli uomini. La prevalenza dell’Alzheimer risulta maggiore nelle donne, in relazione anche all’età, con valori che vanno dallo 0,7% per le donne di età 65-69 anni al 23% per le ultranovantenni, rispetto agli uomini i cui valori vanno dallo 0,6% per la classe d’età 65-69 anni al 17,6% per gli uomini oltre i 90 anni. Il sesso femminile rappresenta, dunque, un importante fattore di rischio per l’insorgenza della demenza di Alzheimer. Anche se la maggior mortalità maschile può parzialmente spiegare queste differenze (le donne infatti sopravvivono più a lungo rispetto agli uomini), è certo però che, la concomitanza con altri fattori, innesca il processo patogenetico della malattia.
Fattori modificabili
I principali fattori di rischio modificabili sono per lo più legati allo stile di vita della persona. Tra questi rientrano:
- Fumo, il quale, secondo alcuni studi, può aumentare il rischio di insorgenza di AD attraverso diversi meccanismi legati allo stress ossidativo e alle risposte infiammatorie;
- Assunzione di alcol, che ha dimostrato indurre danni neuronali, e il suo abuso si associa ad un aumentato rischio di sviluppare AD;
- Abitudini alimentari poco sane: un’alimentazione ricca di acidi grassi saturi e aminoacidi a catena ramificata portano allo sviluppo di malattie cardiovascolari e metaboliche e di conseguenza aumentano significativamente il rischio di demenza. Al contrario, una dieta mediterranea ricca di antiossidanti, fibre e acidi grassi polinsaturi omega-3, può avere un effetto protettivo sul processo neurodegenerativo;
- Sedentarietà: da alcuni studi è merso che l’attività fisica migliora significativamente la funzione cognitiva nelle persone anziane sane. Al contrario, l’inattività fisica è stata associata ad un aumentato il rischio di deterioramento cognitivo nella maggior parte degli studi longitudinali.
Altri fattori
Sono stati poi chiamati in causa altri fattori quali:
- obesità: secondo uno studio, l’obesità può contribuire alla vulnerabilità del tessuto neurale, mentre il mantenimento di un peso sano potrebbe aiutare a preservare la struttura del cervello. Infatti in pazienti con demenza lieve, è stata trovata un’associazione positiva tra l’obesità e il volume della materia grigia attorno alla giunzione temporo-parietale destra;
- diabete: alcuni studi hanno evidenziato che il diabete potrebbe aumentare il rischio di insorgenza di AD influenzando direttamente l’accumulo di Aβ nel cervello, poiché l’iperinsulinemia interrompe la clearance cerebrale di Aβ competendo per l’enzima di degradazione dell’insulina;
- ipertensione: secondo alcune ipotesi l’elevata pressione sanguigna potrebbe aumentare il rischio di AD diminuendo l’integrità vascolare della barriera ematoencefalica, con conseguente stravaso di proteine nel tessuto cerebrale, che può di conseguenza portare a danno cellulare, apoptosi ed aumento dell’accumulo di Aβ;
- sindrome metabolica e malattie vascolari;
- dislipidemie;
- iperomocisteinemia;
- storia di traumi cranici;
- malattie cerebrali;
- disturbi psichiatrici;
- basso livello di istruzione: è stato dimostrato che l’attività cognitiva, sociale ed intellettuale, unitamente all’istruzione superiore e al livello professionale, riduce il rischio di declino cognitivo e di demenza aumentando la riserva cognitiva, la capacità del cervello di resistere agli effetti del danno neuropatologico. Studi osservazionali mostrano costantemente che le persone che si impegnano in attività mentalmente stimolanti hanno meno probabilità di sviluppare AD;
- correlazione della malattia con virus e batteri.
Caratteristiche cliniche e complicanze dell’Alzheimer
Clinicamente, è possibile distinguere due forme di AD:
- Malattia di Alzheimer a esordio precoce, che si manifesta in pazienti con età inferiore a 65 anni;
- Malattia di Alzheimer a esordio tardivo, che si manifesta in pazienti con età superiore ai 65 anni.
Le forme dell’AD
Come già accennato, in base alle cause dello sviluppo della malattia d’Alzheimer le ricerche genetiche hanno identificato forme differenti di Alzheimer:
- una forma familiare, Familial Alzheimer’s disease (FAD), causata da mutazioni autosomiche dominanti nel gene precursore della proteina amiloide (APP) o della presenilina (PS1, PS2), e che può essere ad insorgenza precoce o tardiva;
- una forma sporadica, Sporadic Alzheimer’s disease (SAD), ad insorgenza tardiva, che colpisce circa il 98% dei soggetti affetti, con cause che restano ancora sconosciute;
- una forma associata a sindrome di Down: la maggior parte degli studi ha dimostrato che circa il 50% delle persone con sindrome di Down svilupperà il morbo di Alzheimer all’età di 60 anni.
Decorso della malattia
Dopo la diagnosi di malattia di Alzheimer i pazienti possono vivere mediamente dagli 8 ai 10 anni, durante i quali il decorso è lento, e varia da persona a persona. I sintomi della AD dipendono dallo stadio della patologia. In molti definiscono l’Alzheimer la “malattia delle quattro A”, perché caratterizzata (a seconda dello stato di avanzamento della patologia) da 4 segni tipici dell’Alzheimer, ovvero:
- amnesia, cioè perdita significativa di memoria;
- afasia motoria, vale a dire l’incapacità di esprimersi verbalmente o in forma scritta, e sensoria, cioè di comprendere il significato delle parole dette o scritte;
- agnosia, l’incapacità di riconoscere famigliari o oggetti di sua proprietà;
- aprassia, l’incapacità di compiere movimenti volontari.
Manifestazioni della malattia
La malattia si manifesta inizialmente con lievi disturbi della memoria, fino a concludersi con grossi danni cerebrali che spingono il paziente ad arrivare ad una condizione tale da perdersi in luoghi familiari, ad avere disorientamenti, e a trascurare la propria igiene personale. Gli esperti hanno sviluppato delle “tappe” per descrivere come le abilità di una persona cambino, rispetto alla loro normale funzionalità, a causa del morbo di Alzheimer, e capire in che stato di avanzamento della malattia il soggetto si trova.
Tali tappe definiscono, quindi, lo stato di avanzamento della patologia, che viene misurato attraverso l’aiuto di un esame, il cosiddetto “Mini Mental State Examination” (MMSE), ovvero un breve test, costituito da poche e semplici domande, che ha l’obiettivo di valutare, con una certa affidabilità, lo stato neuro-cognitivo e funzionale di un paziente, e di monitorare la progressione del deficit cognitivo. Sulla base del MMSE, è possibile distinguere 5 stadi di morbo di Alzheimer:
5 stadi di morbo di Alzheimer
- 1. Deterioramento cognitivo lieve: con saltuaria perdita della memoria, in cui le attività cognitive giornaliere restano intatte e non si manifestano, ancora, evidenze cliniche che fanno presupporre ad una demenza;
- 2. Malattia di Alzheimer lieve: con eventi di smemoratezza, brevi periodi di perdita della memoria, domande ripetute, perdita di interessi, compromissione delle attività giornaliere;
- 3. Malattia di Alzheimer moderata : progressione del deficit cognitivo, attività ulteriormente deteriorate della vita quotidiana, sviluppo di segni comportamentali della patologia;
- 4. Malattia di Alzheimer Severa: agitazione, alterazione del sonno, richiesta di assistenza nel vestire, nell’alimentazione. Stabili segni comportamentali e fisiologici propri del morbo di Alzheimer;
- 5. Malattia di Alzheimer molto Severa: è la fase più avanzata della malattia durante la quale la persona malata è completamente dipendente e richiede assistenza continua e totale. Si ha la perdita dell’attività cognitiva, incontinenza, incapacità di riconoscere i propri familiari, di compiere gli atti quotidiani della vita come vestirsi, mangiare, lavarsi.
Cause di morte dei pazienti
La causa di morte più frequente nei pazienti con AD è dovuta all’insorgenza di un fattore esterno come la broncopolmonite, a causa di un deterioramento del sistema immunitario, oltre che ad una perdita di peso corporeo, accrescendo, quindi, la suscettibilità alle infezioni. Altre cause di morte frequenti per questi pazienti sono da associare alle conseguenze ed alle complicanze dovute alle cadute e all’allettamento, come le fratture del femore e le piaghe da decubito.
Diagnosi
Stabilire una diagnosi di Alzheimer implica individuare segni clinici e neuropatologici specifici, mediante l’applicazione di diversi esami, che diano, però, come risultato una diagnosi “possibile” di Alzheimer. Ciò significa che per poter avere una diagnosi “certa” di AD bisogna avvalersi di un’autopsia in seguito a morte del paziente, che consenta di identificare la presenza delle placche amiloidi. Pertanto, durante il decorso della malattia, la diagnosi di Alzheimer non è altro che il risultato di un attento esame clinico che si avvale di una prima fase di screening che consiste in:
- anamnesi, ovvero la raccolta di informazioni dettagliate legate alla storia personale e familiare del paziente (uso di alcolici, farmaci, presenza di malattie, esposizione ad agenti tossici, ecc.);
- esame obiettivo, ovvero la presenza di segni o sintomi obiettivi indicativi di malattie sistemiche e/o neurologiche;
- test neuropsicologici per misurare la memoria, il grado di attenzione, la capacità di contare e dialogare. Tra questi rientra il già citato Mini Mental State Examination (MMSE), ma anche il Milan Overall Dementia Assesment (MODA), un altro strumento di screening per la rilevazione precoce ed il monitoraggio clinico delle sindromi demenziali;
- esami clinici, come quello del sangue, delle urine o del liquido spinale, con l’obiettivo di escludere demenze da encefalopatia tossica e da farmaci, oppure malattie a genesi infiammatoria, endocrina o carenziale.
Test e conferma diagnostica
Alla prima fase di screening segue una seconda fase di conferma diagnostica, attraverso test cerebrali per identificare ogni possibile segno di anomalia. Tra queste rientrano esami sofisticati quali: Risonanza Magnetica, Tomografia ad Emissione di Positroni con Fluorodesossiglucosio (FDG-PET), Tomografia a Emissione di Positroni con tracciante per l’amiloide (Amyloid-PET) e una rachicentesi (puntura lombare) con dosaggio liquorale di beta amiloide e proteina tau.
E’ inoltre di recente pubblicazione lo studio effettuato da ricercatori dell’università di Padova, in collaborazione con l’IRCCS San Raffaele di Roma e altri dipartimenti italiani e finlandesi.
Lo studio
In tale studio si è cercato di identificare, nei soggetti con un disturbo cognitivo lieve non ancora patologico, e quindi a rischio di sviluppare la malattia di Alzheimer, come, utilizzando una nuova tecnica non invasiva e a basso costo, basata sulla combinazione tra stimolazione magnetica transcranica (TMS) ed elettroencefalogramma (EEG), sia possibile individuare dei segni distintivi di funzionamento cerebrale che identificano i soggetti con disturbo cognitivo lieve che rimarranno stabili nel tempo rispetto a quelli che nel giro di pochi anni svilupperanno AD.
Come la maggior parte delle malattie neurodegenerative, è di fondamentale importanza una diagnosi precoce di AD al fine di mirare il trattamento terapeutico e di dare la possibilità al paziente, ancora mentalmente autosufficiente, di capire come meglio affrontare il proprio futuro.
Trattamento e prevenzione
Trattamento farmacologico
Le strategie terapeutiche a disposizione per le demenze sono di tipo farmacologico, psicosociale e di gestione integrata per la continuità assistenziale. Rispetto alle terapie farmacologiche, nonostante ad oggi siano in corso numerosi progetti di ricerca per identificare terapie efficaci nel trattamento delle demenze, gli interventi disponibili non sono ancora in grado di arrestare la malattia. Pertanto i trattamenti farmacologici che vengono somministrati ai pazienti hanno il solo obiettivo di rallentare le manifestazioni cliniche della malattia. Tra questi vi sono:
Inibitori della colinesterasi (donepezil, rivastigmina, galantamina)
Sono indicati nella malattia di Alzheimer in fase lieve/moderata. Si tratta di sostanze che bloccano l’attività dell’acetilcolinesterasi, un’enzima normalmente presente nel cervello deputato alla distruzione dell’acetilcolina. Quest’ultima è un neurotrasmettitore importante per il sistema nervoso, perché permette la comunicazione tra i neuroni, e grazie ad essa vengono regolati i processi dell’attenzione, dell’umore e della memoria. Dopo aver terminato il suo compito, per evitare che si accumuli tra le cellule, l’acetilcolina viene distrutta dall’enzima acetilcolinesterasi. Per cui questo tipo di farmaci blocca l’attività dell’enzima, mantenendo la disponibilità cerebrale di acetilcolina e ridurre la degenerazione neuronale. Inoltre possono migliorare alcuni sintomi cognitivi-comportamentali, tra cui memoria, attenzione, agitazione e allucinazioni, anche se con il progredire della malattia, l’efficacia terapeutica di questi farmaci tende a rallentare.
Memantina (antagonista del recettore NMDA del glutammato)
Indicata nella malattia di Alzheimer in fase moderatamente severa/severa. Essa è una sostanza che protegge le cellule nervose dagli effetti tossici mediati da un eccesso di glutammato, un altro neurotrasmettitore rilevante per i processi di apprendimento e memoria. Tuttavia, il suo accumulo produce un abnorme quantità di calcio nelle cellule nervose, causandone la morte. Oltre ad avere un effetto neuro-protettivo, la memantina agisce anche sulla sintomatologia, migliorando i sintomi cognitivi e comportamentali.
Farmaci per i disturbi del comportamento
utilizzati non solo per la degenerazione cerebrale, ma anche per trattare quelli che sono i disturbi comportamentali legati ad uno scarso adattamento del paziente alla progressione della malattia. Per questo tipo di disturbi si ricorre, con la massima cautela, all’utilizzo di psicofarmaci. Tra questi si annoverano antidepressivi, ansioliotici e ipnotici.
Ricerche innovative
La ricerca si sta, inoltre, soffermando sullo studio di nuove molecole in fase di sperimentazione al fine di sviluppare una terapia mirata al trattamento della malattia di Alzheimer. In particolare si sta lavorando sulla sperimentazione di un farmaco “anti-amiloide” (il peptide che si aggrega per formare le placche senili), che agisce sugli enzimi che rappresentano la chiave di formazione delle placche.
Altra via di ricerca attiva è quella che punta allo sviluppo di una risposta immunologica contro la malattia di Alzheimer, con l’intendo di ricercare un vaccino in grado di prevenire la produzione e l’accumulo di β-amiloide. La sperimentazione si è per un pò interrotta per via del verificarsi di alcuni casi meningo-encefalite, ma è in fase di ripresa.
Sebbene non vi siano interventi in grado di arrestare la malattia di Alzheimer, come per le malattie cronico-degenerative e per le demenze in generale, risulta doveroso definire un insieme di percorsi assistenziali secondo una filosofia di gestione integrata della malattia, che punti a migliorare la qualità della vita del paziente e di coloro che lo assistono.
Trattamento non farmacologico
Nel corso degli anni, complementarmente alle terapie farmacologiche si sono consolidati vari interventi non farmacologici proposti per il trattamento della demenza di Alzheimer. Tra questi, quello di cui esistono le maggiori evidenze scientifiche è la terapia di orientamento alla realtà (ROT), che è stata sviluppata negli anni ’60, finalizzata ad orientare il paziente rispetto alla propria vita personale, all’ambiente e allo spazio che lo circonda tramite stimoli di diverso tipo. Si distinguono due modalità terapeutiche: ROT informale, e ROT formale o in classe.
La prima prevede un processo di stimolazione da parte di chi direttamente assiste il paziente, come badanti o familiari, i quali sono chiamati a riferire ripetute informazioni di orientamento personale, spaziale e temporale, durante l’arco della giornata. Il ROT formale o in classe, invece, consiste in sedute giornaliere di 45 minuti, in gruppi di 4-6 persone, condotte da un tecnico di riabilitazione che utilizza una metodologia di stimolazione standardizzata.
La tecnica del MEMORY TRAINING
In associazione alla ROT può essere usata la tecnica del MEMORY TRAINING, o di allenamento mentale, che consiste nell’utilizzo di strategie che cercano di stimolare e migliorare la memoria procedurale del paziente, coinvolgendolo nelle attività di base della vita quotidiana. Questa tecnica viene svolta da uno specifico operatore che lavora con il paziente in presenza di un familiare. Esempi di attività sono: attività di cura ed igiene personale, attività di cucina o attività di comunicazione con l’esterno.
La terapia della reminescenza
Esistono poi altri interventi orientati alla stimolazione della sfera emotiva, come la terapia della reminescenza, in cui si cerca di stimolare le emozioni del paziente attraverso il ricordo di eventi passati e la comprensione degli effetti emotivi che tale ricordo genera; altre attività sono la musicoterapia, come strumento per ridurre i disturbi del comportamento; la terapia occupazionale, che migliorano la qualità della vita del paziente, il quale è chiamato a svolgere semplici mansioni per tenersi occupato; o la doll-teraphy, in cui si utilizzano delle bambole con specifiche caratteristiche, studiate per sviluppare un senso di attaccamento tale, da migliorare la qualità della vita quotidiana del soggetto.
Prevenzione
Come già accennato, la malattia d’Alzheimer rappresenta la patologia più diffusa tra le diverse forme di demenze nel mondo. Secondo le stime dell’OMS, pubblicate nell’ultimo rapporto su “Alzheimer e Demenze” del 2021, si parla di oltre 55 milioni di malati che, per via dell’invecchiamento della popolazione, diventeranno 78 milioni nel 2030 e 139 nel 2050.
Sfortunatamente, nessuno dei farmaci testati ad oggi negli studi clinici ha mostrato risultati efficaci nel modificare il decorso della malattia di Alzheimer. E’ chiaro però che si potrebbe intervenire su quelli che sono i fattori di rischio, responsabili della AD. Esistono fattori di rischio su cui non è possibile intervenire e che rappresentano, purtroppo, la causa principale di insorgenza di AD. Questi riguardano i già citati “fattori non modificabili”, ovvero l’età, il sesso femminile e la predisposizione genetica. Sebbene non vi è la possibilità di modificare il profilo genetico degli individui, ciò che potrebbe contribuire a rallentare il decorso della malattia è, come già detto, la necessità di una diagnosi precoce.
Tuttavia, un terzo dei casi di AD è attribuibile ai “fattori di rischio modificabili”, pertanto diventa fondamentale, se non indispensabile, la ricerca di strategie in grado di trattare i tali fattori di rischio, ancor prima che i sintomi si presentino e, quindi, prevenire l’insorgenza della malattia. Lavorare, dunque, su diabete, ipertensione, fumo, alcol, attività fisica, attività mentale e soprattutto alimentazione, potrebbe minimizzare gli effetti del decadimento cognitivo.
Lo studio Finlandese
Ad esempio, uno studio Finlandese, cosiddetto FINGER, mirava ad indagare se un intervento multidominio (comprendente dieta, esercizio fisico, training cognitivo e monitoraggio del rischio vascolare) potesse prevenire il declino cognitivo tra le persone anziane. I 1200 partecipanti allo studio FINGER avevano un aumentato rischio di declino cognitivo. Ne è emerso che, a lungo termine, un intervento multidominio può migliorare o mantenere il funzionamento cognitivo nelle persone anziane (60-77 anni ) a rischio di demenza.
Strategie alimentari come prevenzione primaria
In merito a quelli che sono gli interventi applicabili alla dieta, una meta-analisi, comprendente studi prospettici, ha
indagato sulla relazione tra aderenza alla dieta mediterranea e stato di salute, mostrando un’associazione significativa tra una maggiore aderenza alla dieta mediterranea e un ridotto rischio di malattie degenerative croniche importanti, compreso l’AD. La dieta Mediterranea combina diversi alimenti, micro e macronutrienti, già proposti separatamente, come potenziali fattori protettivi contro le sindromi di demenza e predemenza.
La dieta Mind
Negli ultimi anni, inoltre, si sente spesso parlare della cosiddetta dieta MIND (Mediterranean-DASH Intervention for Neurodegenerative Delay), un modello dietetico che associa le caratteristiche della dieta mediterranea a quelle della dieta DASH (Dietary Approaches to Stop Hypertension, ossia Approcci dietetici contro l’ipertensione), garantendo l’effetto benefico di entrambi gli approcci alimentari. Secondo tale modello alimentare si deve privilegiare l’impiego di alimenti come verdure, in particolare quelle a foglia verde, bacche, olio d’oliva, frutta secca, cereali integrali, pesce, fagioli e pollame e scoraggiare l’uso di formaggi (è consentita solo una piccola porzione di formaggio grasso a settimana), margarina, burro, carne rossa, cibi fritti e ricchi di grassi saturi e idrogenati, e alimenti raffinati.
In particolare, l’evidenza epidemiologica suggerisce una possibile associazione tra consumo di pesce, acidi grassi monoinsaturi e acidi grassi polinsaturi (PUFA, omega-3) e un ridotto rischio di declino cognitivo e demenza. E’ stato documentato che il DHA, l’omega-3 maggiormente presente nelle membrane dei neuroni, può contrastare il danno
ossidativo che appare nelle prime fasi della patologia e che porta alla perdita dei neuroni e sopprimere l’attivazione di astrociti e microglia, stabilendo un effetto antinfiammatorio.
Il ruolo dell’EPA
Oltre a quelli sul DHA, altri studi clinici hanno dimostrato che l’EPA (un altro acido grasso omega-3) gioca un ruolo nella fisiologia del cervello. Questo determina un aumento del flusso di sangue cerebrale, con effetti sulla capacità cognitiva e comportamentale.
È stato, inoltre, osservato l’effetto benefico nei confronti del declino cognitivo e della malattia di Alzheimer, quali glutatione (sostanza endogena epatoprotettiva per eccellenza, con attività antiossidante, contenuta anche anche in alcuni alimenti), polifenoli, curcumina (un importante antiossidante presente nella curcuma), coenzima Q10, vitamine B6, B12, folati, lecitina, caffeina, alcuni batteri probiotici. Ma anche catechine ed epigallocatechine (presente in the, cacao e uva), quercetina (capperi, mele, broccoli), luteina (verdure a foglia verde), cianidina (frutti di colori che vanno dal rosso al viola), folati, vitamina E e caffeina.
Modelli alimentari e sostanze nutraceutiche
Pertanto, al fine di rallentare il declino cognitivo è necessario garantire l’impiego di modelli alimentari e, parallelamente, di sostanze nutraceutiche, sia tramite l’assunzione di cibi funzionali, che sottoforma di integratori.
Inoltre altri fattori protettivi che hanno dimostrato avere un effetto protettivo sul processo di neurodegenerazione sono:
- garantire un’attività fisica adeguata alla nostra portata,
- limitare l’assunzione di alcol,
- garantire almeno 8 ore di sonno al giorno
- mantenersi mentalmente attivi.
Il ruolo dei fattori sociali e psicologici
I fattori sociali e psicologici vengono molto spesso sottovalutati, nonostante sia stato dimostrato che, soggetti con un buon bagaglio cognitivo, sebbene presentassero fattori di rischio e lesioni cerebrali tipiche dell’AD, non hanno sviluppato alcun deficit cognitivo e demenza.
Conclusioni
Tuttavia, la necessità di strategie terapeutiche al fine di prevenire il declino cognitivo è ancora urgente. E’ inoltre fondamentale, all’interno di una popolazione che tende ad invecchiare sempre di più, l’attuazione di strategie di prevenzione primaria e secondaria, del fenomeno delle demenze, orientate verso la modifica degli stili di vita e dei fattori di rischio cardiovascolare. La comunità scientifica in campo di malattie cronico-degenerative e di demenze è sempre attiva e attenta verso la ricerca di nuovi interventi di diagnosi precoce, oltre che di trattamenti di prevenzione, per cui ci aspettiamo un cambio di numeri nei prossimi anni.
Fonti
- Farris W, Mansourian S, Chang Y, Lindsley L, Eckman EA, Frosch MP, Eckman CB, Tanzi RE, Selkoe DJ, Guenette S. Insulin-degrading enzyme regulates the levels of insulin, amyloid beta-protein, and the beta-amyloid precursor protein intracellular domain in vivo. Proc Natl Acad Sci U S A. 2003
- Deane R, Wu Z, Zlokovic BV. L’equilibrio RAGE (yin) rispetto a LRP (yang) regola la clearance del beta-peptide amiloide di Alzheimer attraverso il trasporto attraverso la barriera ematoencefalica. Colpo. 2004
- Durazzo TC, Mattsson N, Weiner MW; Alzheimer’s Disease Neuroimaging Initiative. Smoking and increased Alzheimer’s disease risk: a review of potential mechanisms. Alzheimers Dement. 2014
- Stern Y. Cognitive reserve in ageing and Alzheimer’s disease. Lancet Neurol. 2012
- https://www.onb.it
- Rosenberg A, Mangialasche F, Ngandu T, Solomon A, Kivipelto M. Multidomain Interventions to Prevent Cognitive Impairment, Alzheimer’s Disease, and Dementia: From FINGER to World-Wide FINGERS. J Prev Alzheimers Dis. 2020
- Sofi F, Macchi C, Abbate R, Gensini GF, Casini A. Efficacia della dieta mediterranea: può aiutare a ritardare o prevenire la malattia di Alzheimer? J Alzheimer Dis. 2010
- De-Paula VJ, Radanovic M, Diniz BS, Forlenza OV. Alzheimer’s disease. Subcell Biochem. 2012
- Kumar A, Sidhu J, Goyal A, Tsao JW. Alzheimer Disease. 2021 Aug 11. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022
- https://www.salute.gov.it/portale/home.html
- Hardy J, Selkoe DJ. The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics. Science.
Crediti immagini
- Immagine in evidenza:
- Figura 1: https://biografieonline.it/biografia-alois-alzheimer
- Figura 2: https://biomedicalcue.it
- Figura 3: https://studylibit.com
1 commento su “Alzheimer”