Perché si usa
DG18 (Dichloran 18% Glycerol) Agar è un terreno di coltura selettivo impiegato per il conteggio dei lieviti osmofili e delle muffe xerofile negli alimenti secchi o semi-secchi, con un’attività dell’acqua o acqua libera inferiore o uguale a 0,95 (aw ≤ 0,95).
Attività dell’acqua o acqua libera (aw): è la quantità di acqua libera, non legata chimicamente, presente in un alimento.
Osmofilo: microorganismo adattato alla vita in ambienti ad alta pressione osmotica.
Xerofilo: microrganismo che presenta una crescita migliore in condizioni di bassa attività dell’acqua.
Contaminazione degli alimenti da lieviti e muffe
I lieviti e le muffe ritrovabili negli alimenti comprendono più di un centinaio di specie, estremamente versatili nei requisiti ambientali per la sopravvivenza e la crescita. Possono moltiplicarsi tra pH 2 e pH 9, tra 10 e 35°C, o addirittura anche sopra e sotto questi limiti. La maggior parte delle specie di muffe può crescere con un’attività dell’acqua di 0,85 o meno (specie xerofile), mentre le attività metaboliche dei lieviti sono bloccate con un’attività dell’acqua di 0,8. Sia i lieviti che le muffe possono invadere e crescere virtualmente su qualsiasi tipo di alimento, in qualsiasi momento, causandone vari gradi di deterioramento.
Un po’ di storia
I terreni di coltura tradizionali con un’attività dell’acqua molto alta (0,999-0,997) sono adeguati all’isolamento ed al conteggio di lieviti e muffe in alimenti freschi come frutta, verdura, latticini e carne. Per gli alimenti secchi e semisecchi essi si sono dimostrati inadeguati.
Fin da 1929 si utilizzarono terreni contenenti miele per questo scopo. In seguito, per abbassare l’acqua libera nei terreni di coltura, si impiegò saccarosio, glucosio e sodio cloruro.
Pitt e Hocking nel 1977 dimostrarono che il glicerolo è un soluto adatto per la coltivazione di una vasta gamma di funghi xerofili poiché è meno inibitorio del sodio cloruro per alcune specie, produce terreni trasparenti ed è più facilmente manipolabile rispetto agli zuccheri ad alte concentrazioni. King e coll. nel 1979 osservarono come il dicloran, da solo o in combinazione con il rosa bengala, era in grado di limitare lo sviluppo aereo ed il diametro delle colonie fungine.
Combinando queste osservazioni Hocking e Pitt nel 1980 idearono il terreno DG18 Agar, ora raccomandato dalla norma ISO 21527-2 e dal FDA-BAM per il conteggio dei lieviti e delle muffe negli alimenti e nei mangimi con un’attività dell’acqua inferiore o uguale a 0,95 (es. frutta secca, torte, marmellate, carne secca, pesce sotto sale, cereali e prodotti a base di cereali, farine, noci, spezie). Per il conteggio dei lieviti e delle muffe negli alimenti con aw > 0,95 si utilizza il terreno DRBC (Dichloran Rose Bengal Chloramphenicol) Agar, in accordo alla norma ISO 21527-1 ed a FDA-BAM.
Composizione del terreno DG18 Agar
La formulazione del DG18 Agar qui indicata corrisponde a quella riportata dalla norma ISO 21527-2. Il terreno è costituito da una base in polvere e dal supplemento glicerolo da addizionare al terreno di base.
Terreno di base (x litro)
| Digerito enzimatico di caseina | 5 g |
| D-Glucosio | 10 g |
| Potassio diidrogenofosfato | 1 g |
| Magnesio solfato idrato | 0,5 g |
| Dicloran (2,6-dicloro-4-nitroanilina) | 2 mg |
| Cloramfenicolo | 0,1 g* |
| Agar | 12-15 g |
Supplemento (x litro di terreno di base)
| Glicerolo anidro | 220 g |
Come funziona?
Il digerito enzimatico di caseina fornisce azoto, carbonio e minerali per la crescita microbica. Il glucosio è una fonte di carbonio ed energia. Il potassio diidrogenofosfato tampona il terreno ed il solfato di magnesio favorisce la crescita fungina.
Il glicerolo al 18% (w/w) nel terreno riduce l’attività dell’acqua da 0,999 a 0,95, limitando la crescita batterica.
Il dicloran riduce lo sviluppo aereo ed il diametro delle colonie fungine. Questa caratteristica restrittiva rende il terreno di coltura particolarmente adatto per la conta micotica, poiché consente la crescita non oscurata delle specie fungine che sviluppano colonie piccole.
Il cloramfenicolo è un antibiotico ad ampio spettro che sopprima la crescita di un’ampia gamma di batteri Gram-negativi e Gram-positivi.
Preparazione del terreno DG18 Agar
Trasferire in un matraccio tra 28,6 e 31,6 g di terreno in polvere, in funzione della quantità di agar presente nella formulazione disponibile commercialmente. Aggiungere 1000 ml di acqua purificata e mescolare con cura. Portare ad ebollizione agitando frequentemente per sciogliere completamente la polvere ed aggiungere 220 g di glicerolo anidro. Nel caso si utilizzasse un terreno in polvere privo di cloramfenicolo, addizionare 10 ml di una soluzione al 1% in etanolo di cloramfenicolo, oppure il supplemento selettivo liofilizzato disponibile commercialmente, ricostituito secondo le indicazioni del produttore. Sterilizzare in autoclave a 121°C per 15 minuti. Raffreddare a 44-50°C, mescolare bene e distribuire in aliquote da 15 mL in piastre di Petri sterili. Evitare l’esposizione del terreno alla luce.
Metodo di semina
La procedura qui descritta con DG18 Agar è una sintesi del metodo descritto dalla norma ISO 21527-2 per il conteggio di lieviti e muffe negli alimenti e nei prodotti destinati all’alimentazione animale.
- Su una piastra di DG18 Agar, utilizzando una pipetta sterile, trasferire 0,1 ml del campione in esame se liquido o 0,1 ml della sospensione iniziale nel caso di altri prodotti.
- Ripetere questa operazione con le diluizioni successive, utilizzando una nuova pipetta sterile per ogni diluizione decimale.
- Per facilitare il conteggio di cariche fungine basse, distribuire 0,3 mL del campione o 0,3 ml della sospensione iniziale su tre piastre.
- Distribuire uniformemente il liquido sulla superficie dell’agar con un dispositivo sterile fino a completo assorbimento dell’inoculo nel terreno.
- Incubare in aerobiosi a 25 ± 1°C per 5-7 giorni. Se si sospetta la presenza di Xeromyces bisporus, incubare per 10 giorni.
Attenzioni
- Si raccomanda l’uso di un diluente (es. acqua peptonata) contenente una quantità sufficiente di soluto (es. una soluzione di glicerolo o di D-glucosio con una concentrazione compresa tra il 20 e il 35%). Questo riduce al minimo lo shock osmotico delle muffe xerofile e dei lieviti osmofili quando si effettuano diluizioni seriali prima del piastramento. È possibile aggiungere al diluente agenti tensioattivi, come il Tween 80 (0,05 %), per ridurre l’aggregazione delle spore e dei conidi.
- Si raccomanda di incubare le piastre in un sacchetto di plastica aperto per non contaminare l’incubatore in caso di diffusione delle muffe fuori dalle piastre.
- Le spore delle muffe si disperdono nell’aria con grande facilità, maneggiare le piastre di Petri con cura per proteggere l’operatore e per evitare lo sviluppo di colonie satellite che darebbero una sovrastima della popolazione nel campione.
Risultati della crescita
Dopo incubazione, contare le colonie nelle piastre contenenti meno di 150 colonie. Se le muffe a crescita rapida rappresentassero un problema, contare le colonie dopo 2 giorni e di nuovo dopo 5-7 giorni di incubazione.
Se necessario, effettuare un esame delle colonie con una lente d’ingrandimento binoculare o con un microscopio al fine di distinguere le cellule di lieviti o muffe dai batteri e, se richiesto, contare separatamente le colonie di lieviti e le colonie di muffe.
Per l’identificazione, selezionare le aree di crescita fungina e rimuoverle per un esame microscopico ad elevato ingrandimento o per inoculare gli appropriati terreni di isolamento o di identificazione.
Riportare i risultati come numero di colonie fungine osmofile/xerofile per grammo o millilitro di campione.
Immagini
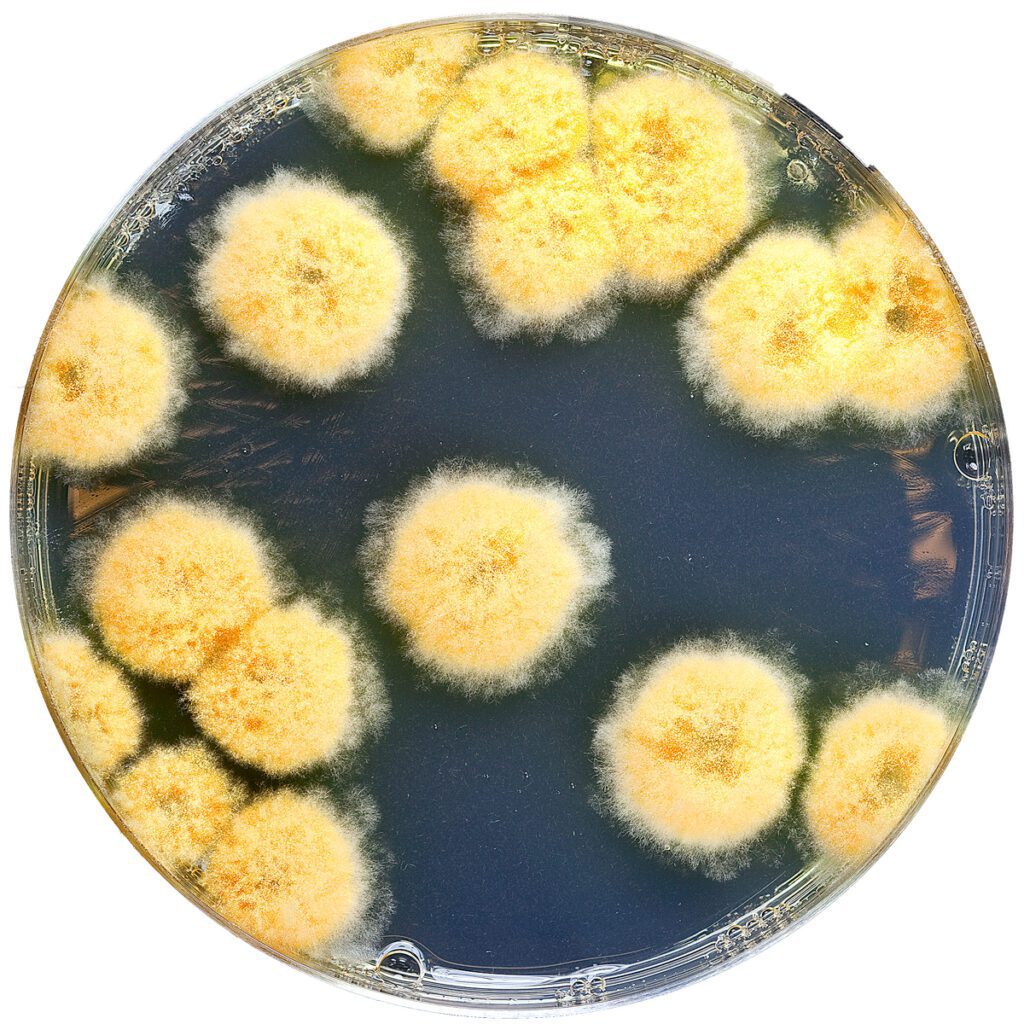


Controllo qualità DG18 Agar
I terreni disponibili commercialmente sono sottoposti a rigorosi controlli di qualità per verificarne la conformità alle specifiche. L’utilizzatore può comunque eseguire il proprio controllo di qualità sulle piastre preparate in laboratorio, in funzione dei requisiti regolamentari e delle norme di accreditamento. ISO 11133 suggerisce i ceppi indicati in tabella, avendo come riferimento il Sabouraud Dextrose Agar, per calcolare l’indice di produttività (PR = UFC su DG18 Agar/UFC su SDA).
| Ceppo | Collezione | Tipo di test | Inoculo | Risultati attesi |
| Saccharomyces cerevisiae | ATCC 9763 | Quantitativo | 80-120 UFC/piastra | PR ≥ 0,5 * |
| Wallemia sebi | ATCC 42694 | Quantitativo | 80-120 UFC/piastra | PR ≥ 0,5 * |
| Aspergillus restrictus | ATCC 42693 | Quantitativo | 80-120 UFC/piastra | PR ≥ 0,5 * |
| Eurotium rubrum | ATCC 42690 | Quantitativo | 80-120 UFC/piastra | PR ≥ 0,5 * |
| Escherichia coli | ATCC 25922 | Qualitativo | 104 – 106 UFC/piastra | Nessuna crescita |
| Bacillus subtilis subsp. spizizenii | ATCC 6633 | Qualitativo | 104 – 106 UFC/piastra | Nessuna crescita |
Limitazioni all’utilizzo del DG18 Agar
- Evitare l’esposizione del terreno alla luce, poiché i prodotti di decomposizione citotossica possono determinare una sottostima della microflora nei campioni.
- Il metodo qui descritto non si applica ai prodotti disidratati con attività dell’acqua inferiore o uguale a 0,60 e non consente l’enumerazione delle spore di muffa.
- Il metodo qui descritto non è adatto per l’enumerazione di funghi alofili e xerofili (ad esempio Polypaecilum pisce, Basipetospora halophila) come quelli che si possono trovare nel pesce essiccato.
- Secondo la norma ISO 21527-2, quando per determinati campioni la sovra-crescita batterica può costituire un problema, si può impiegare una associazione di cloramfenicolo 50 mg/L e cloratetraciclina HCl 50 mg/L. In questo caso utilizzare un terreno in polvere privo di cloramfenicolo ed addizionare le appropriate soluzioni dei due antibiotici.
- I metodi di conteggio dei lieviti e soprattutto delle muffe sono imprecisi perché essi sono costituiti da una miscela di micelio e spore asessuate e sessuate. Il numero di unità formanti colonie dipende dal grado di frammentazione del micelio e dalla proporzione di spore in grado di crescere sul terreno in piastra.
Fonti
- Biolife IFU
- FDA-BAM Chapter 18: Yeasts, Molds and Mycotoxins. Content current as of: 11/07/2022.
- Hocking AD, Pitt JI. Dichloran-glycerol medium for enumeration of xerophilic fungi from low moisture foods. Appl Enviornm Microbiol 1980; 39;488-492.
- ISO 21527-1. Microbiology of food and animal feeding stuffs — Horizontal method for the enumeration of yeasts and moulds — Part 1: Colony count technique in products with water activity greater than 0,95.
- ISO 21527-2:2008. Microbiology of food and animal feeding stuffs — Horizontal method for the enumeration of yeasts and moulds — Part 1: Colony count technique in products with water activity less than or equal to 0,95.
- ISO 11133:2014 Microbiology of food, animal feed and water — Preparation, production, storage and performance testing of culture media.
- King AD, Hocking AD, Pitt JI. Dichloran-rose bengal medium for enumeration and isolation of molds from foods. Appl Environ Microbiol 1979; 37:959-964.
- Merck IFU.
- Pitt JI, Hocking AD 1977. Influence of solute and hydrogen ion concentration on the water relations of some xerophilic fungi. J Gen Microbiol 1977; 101:35-40.
- Oxoid IFU.