Caratteristiche
Il termine Propionibacterium (o Cutibacterium) indica un genere di batteri che include più di 13 specie (tra queste abbiamo P. acnes, P. avidum, P. granulosum, P. lymphophilum, P. jensenii, P. thoenii, P. freudenreichii, per citarne alcune) e che appartiene al phylum degli Attinomiceti. Sono bacilli Gram-positivi pleomorfi (Fig. 1), anaerobi e aerotolleranti, asporigeni, catalasi positivi, immobili, da 1 a 5 μm di lunghezza, a crescita lenta, capaci di sintetizzare acido propionico e acido acetico a partire dal glucosio e dal lattato.
Grazie a un progetto genomico sul P. acnes KPA1202 si è scoperto che l’intera sequenza genomica di tale microorganismo contiene 2333 geni codificanti per enzimi coinvolti nella degradazione delle molecole dell’organismo ospite, tra cui le sialidasi, le neuraminidasi, le endoglicoceramidasi e le lipasi.
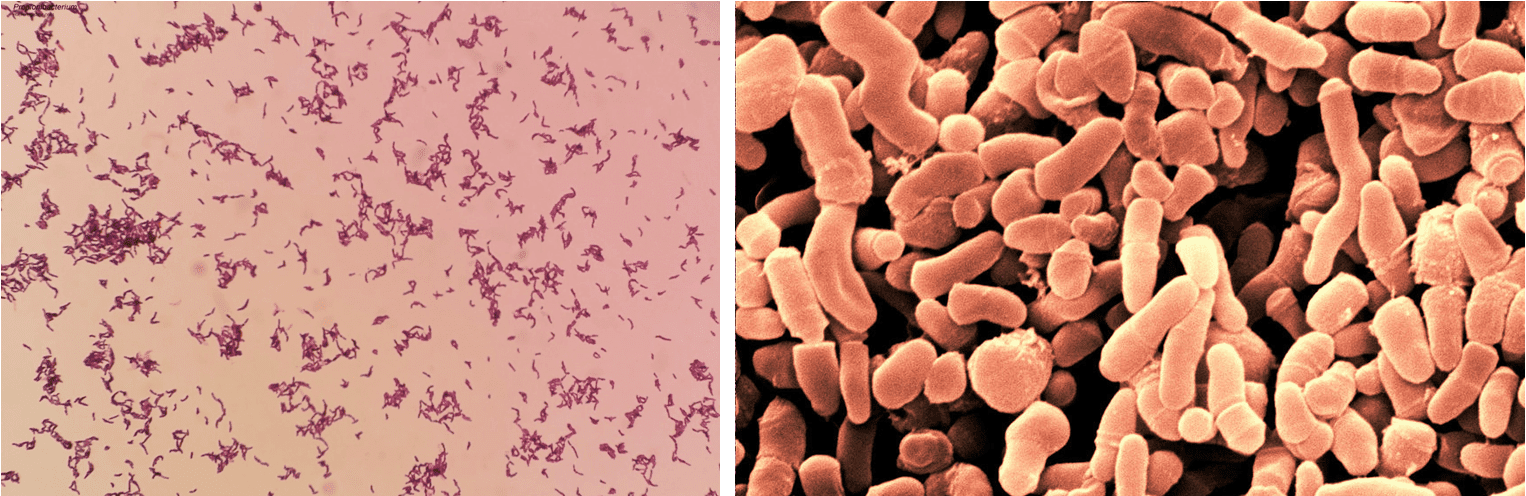
I batteri del genere Propionibacterium fanno parte della flora commensale degli esseri umani e di altri animali, e risiedono principalmente nelle ghiandole sudoripare e sebacee, e in altre zone della cute. Tuttavia, possono essere recuperati dai tratti gastrointestinale e urogenitale, e dalle vie respiratorie superiori. Dal momento che si trovano sulla cute, spesso possono contaminare campioni come sangue e altri fluidi corporei in seguito alla puntura al momento del prelievo.
Alcuni membri di questo gruppo vengono largamente impiegati nella produzione della vitamina B12 e dei composti tetrapirrolici (composti chimici con quattro anelli formati a loro volta da quattro atomi di carbonio e uno di azoto; ad esempio le porfirine, la bilirubina, la biliverdina, la clorofilla), come anche nel settore caseario e dei probiotici. In questi campi l’ingegneria genetica ha permesso di trasformare i batteri del genere Propionibacterium con dei plasmidi shuttle che sono stati sviluppati a partire da plasmidi endogeni presenti nei Propionibacteria e nell’Escherichia coli. Grazie a queste metodiche si è giunti alla creazione di un P. freudenreichii in grado di produrre l’enzima colesterolo ossidasi, impiegato nel dosaggio del colesterolo nel siero. Inoltre, nei Propionibacteria sono stati isolati i geni implicati nella biosintesi della vitamina B12 e dell’acido 5-aminolevulinico (ALA, che rientra nella via biosintetica delle porfirine, importante per la genesi dell’emoglobina e della clorofilla); quest’ultimo può essere generato sia dal pathway C4 (attraverso la condensazione dell’amminoacido glicina e del succinil-coenzima A) che dal pathway C5 (a partire dall’amminoacido glutammato).
Nella fabbricazione dei formaggi, il ceppo P. freudenreichii sottospecie shermanii viene usato insieme a Lactobacillus delbrueckii sottospecie bulgaricus. Quest’ultimo esprime enzimi proteolitici con i quali degrada la caseina in amminoacidi liberi e peptidi; P. freudenreichii, che è dipendente da queste molecole, rilascia anidride carbonica con conseguente formazione di bolle che diventano i classici buchi rotondi nel formaggio svizzero (Fig. 2).

Filogenesi
Dominio Prokaryota
Regno Bacteria
Phylum Actinobacteria
Classe Actinobacteria
Ordine Propionibacteriales
Famiglia Propionibacteriaceae
Genere Propionibacterium
Morfologia delle colonie
Su agar sangue e agar Schaedler (un terreno nutritivo contenente emina, vitamina K1, sangue di montone al 5%, esclusivo per la crescita di batteri anaerobi obbligati) le colonie appaiono convesse, semiopache, luccicanti, biancastre o color ruggine (Fig. 3). Alcune specie, come P. avidum, P. acnes e P. namnetense, formano un alone di beta-emolisi grazie alla produzione di emolisine. Tale capacità si perde completamente dopo riscaldamento a 60 °C per cinque minuti, come anche in seguito al trattamento con DNAsi, chimotripsina o pronase (una miscela di proteasi ottenute dal fluido extracellulare di Streptomyces griseus).
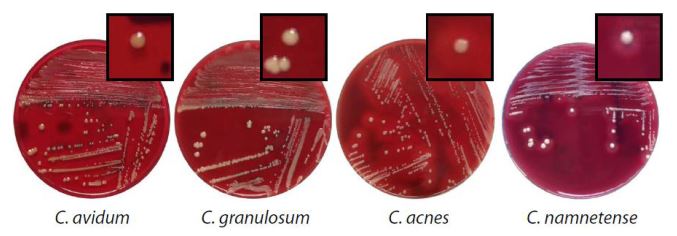
Comunque, il mezzo specifico per la coltivazione e l’isolamento dei batteri del genere Propionibacterium è l’agar YELA (Yeast extract sodium lactate), un terreno contenente lattato di sodio, che viene convertito in acido propionico, acido acetico e anidride carbonica. Le colonie batteriche appaiono marroni e con un diametro maggiore di 1 mm.
Patogenesi
Come abbiamo accennato all’inizio, i Propionibacteria sono batteri commensali che vivono soprattutto sulla cute, e di solito non sono patogeni. Tuttavia, esistono patologie provocate da questi batteri, e una delle più studiate è l’acne vulgaris, legata a P. acnes; questi si può trovare sulla cute dei prepuberali, anche se la vera e propria colonizzazione inizia uno o tre anni prima della maturazione sessuale. Il numero di batteri aumenta da meno di 10/cm fino a 10⁵/cm, e si concentra soprattutto sul viso e sulle aree circostanti.
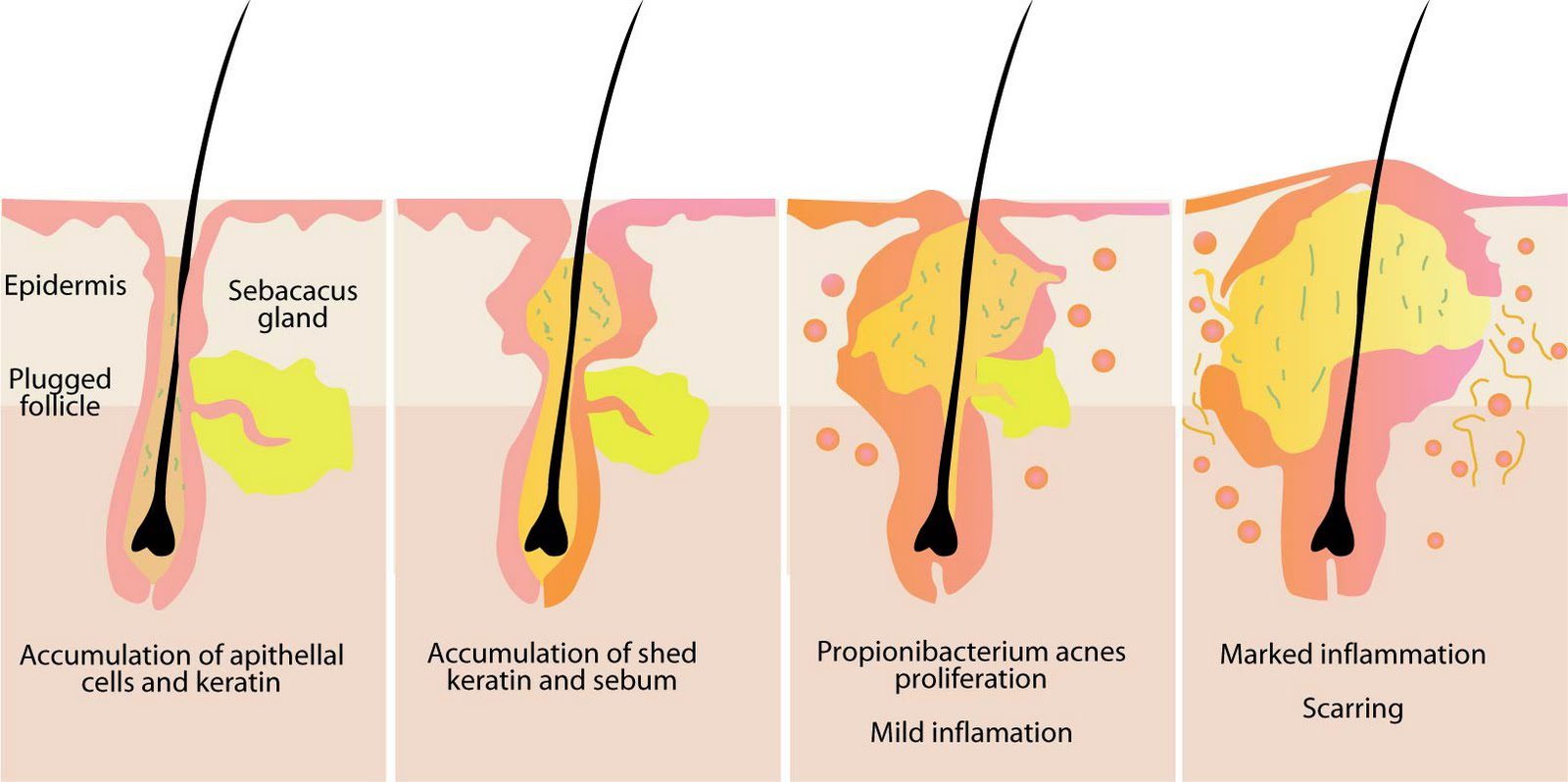
L’acne vulgaris si manifesta prevalentemente durante l’adolescenza, periodo in cui i flussi degli androgeni aumentano la sintesi del sebo e la proliferazione dei cheratinociti (cellule che compongono lo strato più esterno della cute, l’epidermide). Ci sono, però ulteriori fattori che concorrono all’insorgenza, tra cui umidità, sudorazione, cambiamenti ormonali (durante la gravidanza o il ciclo mestruale per esempio), diete ricche di cibi ad alto contenuto glicemico, uso di cosmetici che impediscono l’evaporazione dell’acqua, detergenti, lozioni e indumenti. Questa malattia è caratterizzata dalla comparsa di lesioni cutanee sulla faccia e sulla parte superiore del tronco, tra cui comedoni, papule, pustole, noduli e/o cisti in conseguenza al blocco e all’infiammazione delle unità pilosebacee, ovvero i follicoli piliferi e le ghiandole sebacee corrispondenti. La manifestazione dell’acne è favorita dalla sinergia di quattro fattori primari, ossia la sovrabbondante produzione di sebo, l’occlusione del follicolo con sebo e cheratinociti, l’invasione dei follicoli da parte di P. acnes e la liberazioni di fattori infiammatori (citochine e chemochine) (Fig. 4).
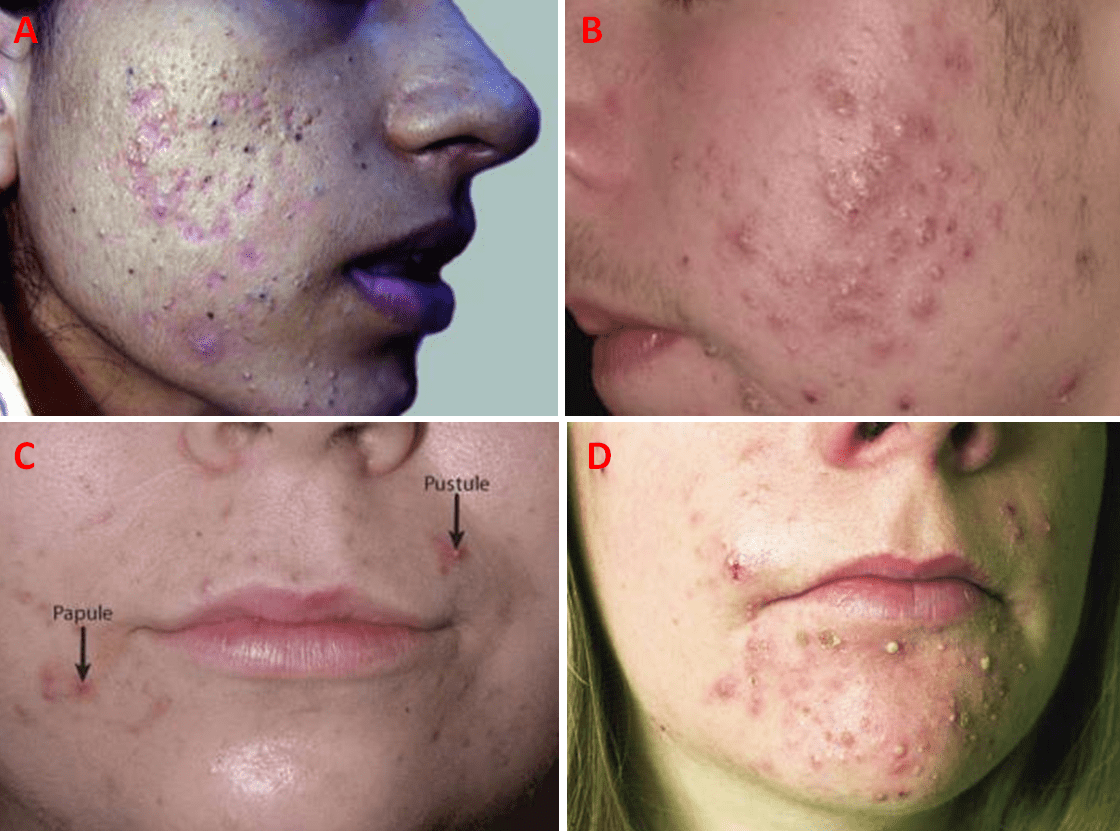
Esistono due categorie di acne vulgaris, cioè non infiammatoria e infiammatoria. La prima è distinta dalla presenza di comedoni, che sono tappi di sebo trattenuti all’interno del follicoli, e sono definiti chiusi o aperti in base alla dilatazione o alla chiusura a livello della superficie cutanea; i primi (definiti punti bianchi) sono lesioni palpabili biancastre o rosa carne, di 1-3 mm di diametro (Fig. 5A), i secondi (noti come punti neri) hanno sembianze simili ma presentano una zona centrale scura (Fig. 5A). Se i comedoni sono aperti, è più facile rimuovere i tappi sebacei, ma tale operazione diventa più ardua se, al contrario, i comedoni sono chiusi. Questi ultimi anticipano l’acne infiammatoria, la quale si sviluppa con papule e pustole (Fig. 5B, 5C, e 5D), che si mostrano rosse e con un diametro di 2-5 mm; la formazione di tali lesioni avviene nel momento in cui il P. acnes occupa i comedoni chiusi e converte il sebo in acidi grassi liberi, responsabili dell’irritazione dell’epitelio follicolare e della risposta infiammatoria mediata dai granulociti neutrofili e dai linfociti, i quali contribuiscono alla disgregazione ulteriore dell’epitelio. Si verificano, quindi, gli sfondamenti del follicolo infiammato del derma, dove le sostanze contenute nel comedone inducono una reazione infiammatoria aggiuntiva locale che conduce alla generazione di papule. Nel caso in cui l’infiammazione è violenta, compaiono le pustole purulente, cioè che racchiudono il pus (una sostanza bianco-giallastra formata da neutrofili morti o morenti) (Fig. 5C e 5D).
Nell’acne infiammatoria possono manifestarsi anche noduli e cisti; i primi sono lesioni profonde che interessano più di un follicolo, mentre le seconde sono grandi noduli suppurati. C’è da sottolineare che l’acne cistica, se dura a lungo, può determinare la formazioni di cicatrici che appaiono come fossette profonde e di piccole dimensioni (cicatrici a pozzetto), fossette di dimensioni maggiori, cavità superficiali (Fig. 6A) o cicatrici ipertrofiche (cheloidi) (Fig. 6B).

Si conclude questa sezione dedicata all’acne vulgaris con una descrizione di tre forme gravi di questa malattia, ovvero l’acne conglobata (Fig. 7A), l’acne fulminante (Fig. 7B) e il pioderma facciale (Fig. 7C). La prima, che è la più severa e riguarda maggiormente i maschi, è contraddistinta da ascessi, fistole drenanti (comunicazioni patologiche tra due strutture o due cavità dell’organismo, con rilascio di materiale sieroso o purulento), comedoni fistolizzati e cheloidi. Oltre al viso, coinvolge notevolmente il dorso e il torace, ma può diffondersi anche a braccia, addome, glutei e cuoio capelluto.
La seconda raffigura una versione ulcerativa dell’acne conglobata, e si presenta con febbre, croste sanguinanti, ascessi confluenti che portano a necrosi emorragica, epatosplenomegalia e perdita di peso.
Queste due varianti, oltre ad essere correlate a un’intensa reazione di ipersensibilità al P. acnes, sono state associate a incremento della produzione di androgeni, predisposizione genetica (per esempio aneuploidia XYY, cioè maschi con un cromosoma Y in più) e malattie autoimmuni. Inoltre, un’ulteriore spinta accelerativa è dovuta all’utilizzo di steroidi anabolizzanti e di isotretinoina orale (un farmaco usato per il trattamento dell’acne cistica).
L’ultima, che può essere simile all’acne fulminante, si manifesta in maniera repentina sulla zona centrale del volto di giovani donne con placche eritematose e pustole su mento, guance e fronte.

Adesso si vorrà concentrare l’attenzione sulla patogenesi legata al P. avidum, il quale è responsabile di infezioni conseguenti a rottura della pelle e perdita dell’integrità cutanea. Questa specie può essere recuperata dopo le operazioni chirurgiche, in particolare successivamente a procedure ortopediche, mammarie e cardiache.
Le operazioni chirurgiche che consistono nell’inserire impianti mammari ricostruttivi o estetici sono potenzialmente vulnerabili a infezioni da diversi batteri, come Staphylococcus aureus e Propionibacterium.
Due lavori pubblicati su Journal of Surgical Case Reports e su New Microbs new Infection, nel 2015, documentarono un caso che coinvolse una donna di 37 anni, la quale, si era sottoposta a un’operazione di mastoplastica riduttiva. Un mese dopo tornò in ospedale lamentando febbre e un doloroso indurimento alla mammella destra; l’esame fisico rivelò la presenza di una lesione ulcerativa circolare sotto al seno, attorniata da cellulite (Fig. 8).
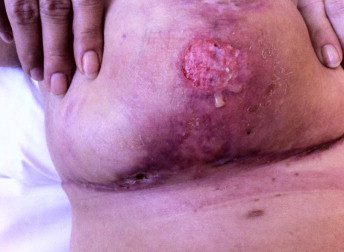
Gli esami ematochimici segnalarono livelli alti della proteina C reattiva (16 mg/dl), l’analisi agli ultrasuoni mostrò un accumulo di liquido, che venne prelevato mediante agoaspirazione, rivelando la presenza di pus, e su cui furono eseguiti esami microbiologici. Mediante l’indagine al microscopio, previa colorazione di Gram, si notarono numerosi leucociti e nessun microorganismo visibile. Tuttavia, la coltura su agar Schaedler diede come risultato una moderata crescita di colonie mucoidi e biancastre in anaerobiosi, e infine, grazie alla spettrometria di massa con MALDI-TOF (matrix-assisted laser desorption-ionization time-of-flight), le colonie furono identificate come appartenenti al P. avidum. In questa circostanza ciò che può aver giocato un ruolo nella contaminazione della ferita è la vicinanza della regione ascellare.
Un articolo del 2013, pubblicato su Pathologie Biologie, descrisse un caso di ascesso intraperitoneale e gonfiore addominale causati da P. avidum come complicazioni di una addominoplastica in una donna di 46 anni. Si può ipotizzare che il batterio fosse nascosto sotto le pieghe cutanee e che l’infezione fosse dovuta alla contiguità con la cicatrice.
Nel 1997 un uomo di 79 anni fu vittima di un ascesso splenico da P. avidum in seguito a cateterizzazione cardiaca con angioplastica. Dopo tre giorni manifestava febbre, dolore all’addome e alla spalla sinistra; la scansione addominale permise di individuare una massa splenica cistica e omogenea, che si pensava fosse un ematoma della milza. L’ascesso appariva parzialmente fibrotico e conteneva tessuto di granulazione; all’esame istologico si distinsero emboli di colesterolo all’interno delle arteriole spleniche adiacenti all’ascesso, mentre tramite l’esame colturale risultò positivo al P. avidum.
Ci sono stati diversi casi di endocarditi infettive connesse a P. avidum. Uno di questi, del 2001, concerne un uomo di 67 anni, ex fumatore, con precedenti di sostituzione valvolare aortica con protesi meccanica. Venne ricoverato in ospedale a causa di una febbre prolungata; le analisi di laboratorio ravvisarono anemia, aumento della velocità di eritrosedimentazione (segno di infiammazione), presenza di cilindri ematici ed eritrociti dismorfici nelle urine. All’ecografia addominale fegato e milza si presentavano ingrossati, e l’ecocardiogramma trans-esofageo individuò un ascesso all’anello aortico. L’emocoltura si rivelò positiva a bacilli Gram-positivi che furono identificati come P. avidum.
Considerando la nicchia in cui si trova P. avidum, è alquanto insolito che giochi un ruolo nelle infezioni di ossa e articolazioni. Ciononostante, si sono verificati degli episodi di questo tipo di infezione; un articolo del 2008, pubblicato su Joint Bone Spine, illustrò un evento di artrite settica dell’anca con batteriemia da P. avidum, in una donna di 78 anni, in seguito al trattamento intra-articolare con glucocorticoidi per l’osteoartrite dell’anca.
Un’altra patologia a cui è collegato il Propionibacterium è il carcinoma prostatico; P. acnes rappresenta il microorganismo isolato più sovente da campioni di prostatectomia radicale, raggiungendo un tasso da 23% a 60% nei casi di carcinoma prostatico. In un lavoro del 2010, pubblicato su BMC Microbiology, i ricercatori studiarono la risposta immunitaria stimolata dal P. acnes in cellule epiteliali prostatiche in coltura; queste cellule, nel momento in cui venivano infettate dal P. acnes, erano spinte a rilasciare citochine pro-infiammatorie, come interleuchina 6 (IL-6), interleuchina 8 (IL-8) e GM-CSF (fattore stimolante le colonie granulocito-macrofagiche). La secrezione di queste molecole di segnalazione era associata all’up-regolazione del fattore di trascrizione NF-kB (nuclear factor kappa-light-chain-enhancer of activated B cells) come di diversi altri componenti del pathway TLR2 (Toll-Like Receptor 2)-NFkB.
Per concludere, un’ulteriore malattia in cui P. avidum è implicato è la carie. Il pH della bocca, che è vicino a 6, è ottimale per la crescita del P. avidum, e il pH della placca (sostanza polisaccaridica formata dal biofilm dei batteri orali) può facilitare lo sviluppo del batterio, soprattutto dopo l’esposizione agli zuccheri. Bisogna evidenziare che l’interazione con altre specie batteriche, come Streptococcus mutans (il maggiore responsabile della carie), può favorire l’insorgenza della carie. Quindi, la ripetuta esposizione a diete ricche di carboidrati e amido incrementa la placca metabolicamente attiva, con formazione di lesioni distinte. La fermentazione del sucrosio, del sorbitolo o dello xilitolo da parte del P. avidum può avere come conseguenza la formazione di lesioni simili alla carie sullo smalto.
Metodi di identificazione
La ricerca dei batteri del genere Propionibacterium può essere eseguita con diverse metodiche. Tra queste abbiamo l’esame colturale su agar sangue o su Schaedler agar, su cui si formano colonie lucide, mucoidi, color ruggine o biancastre; seguono i saggi di conferma che consistono nel testare la produzione di indolo (sottoprodotto della digestione dell’amminoacido triptofano), il rilascio di emolisine e la riduzione dei nitrati. Al fine di identificare la specie, è possibile ricorrere al profilo biochimico analizzando l’espressione degli enzimi: per esempio, in un lavoro pubblicato su Journal of Clinical Microbiology, del 1977, Ulrich Hoeffler esaminò 33 isolati di P. avidum, 40 di P. acnes e 18 di P. granulosum per la produzione di condroitin solfatasi, ialuronidasi, DNasi, fosfatasi e lecitinasi. In gran parte dei ceppi di P. avidum non fu individuata la condroitin solfatasi (solo nel 28%), mentre il 68% dei ceppi di P. acnes erano positivi a tale enzima. La maggioranza dei ceppi di C. avidum esibiva attività della DNasi e della gelatinasi, anche se molti risultarono negativi alla ialuronidasi e alla lecitinasi. Per quanto concerne la fosfatasi, le specie di Propionibacterium erano negative o debolmente positive.
Negli esami di routine, utili come test di screening, rientrano la valutazione microscopica dopo colorazione di Gram su colonie sospette (che si presentano di colore arancio e con una beta-emolisi significativa), il test della catalasi, dell’idrolisi dell’esculina e il CAMP test. Al giorno d’oggi queste tecniche sono considerate obsolete, in quanto suscettibili a errori di lettura da parte degli operatori; con l’avvento della spettrometria di massa con MALDI-TOF, l’identificazione è più accurata e rapida.
Un ulteriore metodologia è l’analisi molecolare mediante l’amplificazione e il sequenziamento del gene codificante per l’RNA ribosomiale 16S (16S rRNA), anche se un maggiore potere di discriminazione si può ottenere usando come target i geni rpoB e gyrB, che codificano rispettivamente per la subunità beta dell’RNA polimerasi e la subunità beta della DNA girasi. In aggiunta a ciò, il sequenziamento di gyrB consente di distinguere P. avidum da P. namnetense.
Dal momento che è stato fornito un quadro approfondito sulla patogenesi dell’acne vulgaris, è opportuno inserire in questa sezione una spiegazione della diagnosi di tale malattia. L’approccio diagnostico dell’acne vulgaris si fonda sull’apprezzamento dei fattori coadiuvanti, come ormoni, farmaci o cosmetici, la definizione della gravità (lieve, moderata o grave), e la considerazione dell’impatto psico-sociale. Inoltre, si esegue una diagnosi differenziale che include la discriminazione con altre patologie cutanee, tra cui:
- La rosacea, caratterizzata da comedoni non evidenti, arrossamento, eritema, papule, pustole e, nei casi più critici, rinofima (alterazione della struttura cutanea del naso, che si ingrossa in maniera sproporzionata);
- L’acne da corticosteroidi, in cui non sono presenti comedoni e le pustole si trovano nello stesso stadio evolutivo. Compare specialmente su tronco, spalle e braccia;
- La dermatite periorale, un’eruzione eritematosa e papulopustolosa che si manifesta inizialmente intorno alla bocca;
- L’eruzione acneica indotta da farmaci.
Per quanto concerne le varianti più dannose, come l’acne fulminante (che può essere associata a sintomi sistemici), la diagnosi è basata sulla conta delle cellule ematiche, in cui i globuli bianchi possono risultare elevati con un’alta percentuale di neutrofili, sull’esame della velocità di eritrosedimentazione e il dosaggio della proteina C reattiva (entrambe possono essere alte), il test di funzionalità epatica e il dosaggio della gonadotropina corionica nelle femmine. Un ulteriore esame è la diagnostica con metodi di imaging, in quanto uno dei sintomi dell’acne fulminante è anche dolore alle ossa e alle articolazioni; nel 50% dei pazienti, tale metodica consente di evidenziare lesioni osteolitiche, ossia sezioni ammorbidite dell’osso. La coltura di tali lesioni ossee spesso dà risultati negativi.
Terapia
Riguardo agli approcci terapeutici per l’infezione da Propionibacterium, non esiste un gold standard. In un articolo del 2016, Neel B. Shah e colleghi proposero degli schemi terapeutici per le infezione ossee legate alle protesi, ovvero terapia di prima linea con penicillina da 20 a 40 milioni di unità, oppure cefriaxone 2 g (entrambi somministrati giornalmente); terapia di seconda linea con clindamicina da 600 a 900 mg somministrata ogni 8 ore, o vancomicina a 15 mg/kg somministrata ogni 12 ore.
Se ora spostiamo l’attenzione sul trattamento dell’ance vulgaris, esso consiste nell’uso dei seguenti farmaci:
- Per i comedoni si ricorre alla tretinoina topica, che non è altro che acido retinoico, ed è impiegato anche nella cura della leucemia promielocitica. Nel caso di intolleranza, si può ricorrere a retinoidi come l’adapalene gel e il tazarotene crema o gel, oppure all’acido azelaico crema;
- Retinoide topico (da solo o accoppiato a un antibiotico topico come l’eritromicina o la clindamicina) per l’acne infiammatoria lieve. È possibile aggiungere il perossido di benzoile al fine di ridurre lo sviluppo della resistenza agli antibiotici;
- Isotretinoina orale per l’acne grave. Si tratta di una stereoisomero dell’acido retinoico;
- Isotretinoina orale oppure triamcinolone (corticosteroide sintetico) applicato nelle lesioni per l’acne cistica;
- Per l’acne fulminante, invece, la terapia migliore consta di una combinazione di corticosteroidi e isotretinoina. Bisogna sottolineare che questo tipo di acne non risponde ai tradizionali antibiotici.
Se la terapia topica si rivela impraticabile perché le lesioni si sono diffuse in varie parti del corpo, è consigliabile l’uso di antibiotici orali, come la tetraciclina, la minociclina e la doxiciclina.
Approcci biotecnologici
Come abbiamo accennato all’inizio, questi batteri sono impiegati nell’industria del formaggio, in particolare di quello svizzero; il loro ruolo nella produzione casearia si fonda sulla fermentazione dell’acido lattico (rilasciato dai batteri della microflora del formaggio, come Lactobacillus, Lactococcus, Pediococcus, Streptococcus, Aerococcus) ad acido propionico e acido acetico, che danno uno specifico aroma al prodotto finale. Funzionano anche come conservanti naturali. In aggiunta a ciò, i batteri che sintetizzano acido propionico e quelli che generano acido lattico (Lactobacillus plantarum, Lactobacillus acidophilus) vengono usati nella fabbricazione delle verdure sottaceto, dal momento che la combinazione dei due gruppi di batteri incrementa la velocità del processo di fermentazione e protegge il prodotto finale dall’attacco di muffe e dalla putrefazione, oltre al fatto che i sottaceti ottenuti con questo metodo sono arricchiti di vitamina B12 (una delle molecole sintetizzate dai Propionibacteria) e, tra l’altro, il loro sapore e le loro proprietà dietetiche sono migliori.
È importante sottolineare che il P. freudenreichii sottospecie shermanii possiede la capacità di indurre l’apoptosi (morte cellulare programmata) delle cellule tumorali del colon, e ciò è legato al rilascio di acidi grassi a catena corta come il propionato e l’acetato. Questa abilità è stata documentata in un lavoro del 2016, pubblicato su Oncotarget, in cui si è visto che la sinergia tra l’azione degli acido grassi a catena corta (che agiscono sui mitocondri) e il pathway di TRAIL [TNF-Related Apoptosis-Inducing Ligand (ligando inducente l’apoptosi mediante il fattore di necrosi tumorale)], un induttore dell’apoptosi attivante la via estrinseca, aumenta l’espressione dei geni pro-apoptotici e diminuisce i geni anti-apoptotici. Rimanendo su questo argomento, è utile riportare uno studio del 2017, pubblicato su International Dairy Journal, che espose l’uso di P. freudenreichii sottospecie shermanii come un additivo promuovente la salute nel formaggio greco; i ricercatori scoprirono che le unita formanti colonia (CFU) del batterio, durante la maturazione del prodotto, aumentavano nel giro di sette giorni e rimanevano costanti fino alla fine del processo. Inoltre, nell’arco di 60 giorni, la concentrazione di acido propionico arrivava fino a 52,1 mM. Il formaggio così ottenuto presentava delle proprietà favorevoli per la salute e la sua data di scadenza era prolungata.
Un ulteriore utilizzo dei Propionibacteria, come di altri PAB (batteri che sintetizzano acido propionico, come il Clostridium propionicum e il Bacteroides ruminicola), riguarda la fabbricazione del mangime (Bioprofitᵀᴹ), in quanto sono fonti di vitamina B12, facilitano l’assimilazione del ferro e del calcio e proteggono il prodotto finale dalle infezioni fungine. In aggiunta a ciò, questi batteri vengono impiegati come probiotici nel nutrimento degli animali, poiché, grazie alla sintesi di acido propionico, regolano la flora intestinale stimolando la proliferazione di batteri benefici come i bifidobatteri.
Detto questo, i PAB raffigurano dei possibili sostituti per la conservazione di latticini, frutta e verdura con effetti benevoli sulla salute.
Fonti
- https://catalog.hardydiagnostics.com/cp_prod/content/hugo/propionibacterium.htm
- https://microbewiki.kenyon.edu/index.php/Propionibacterium
- Kiatpapan P., Murooka Y. 2002. “Genetic manipulation system in propionibacteria”, Journal of Bioscience and Bioengineering
- Rust, Susanne. 2012. “UC Berkeley Bacteria Study: Research Shows Humans A Major Source Of Germs”, Huffington Post
- Stéphane Corvec. 2018 “Clinical and Biological Features of Cutibacterium (Formerly Propionibacterium) avidum, an Underrecognized Microorganism”, Clinical Microbiology Review
- https://legacy.bd.com/europe/regulatory/Assets/IFU/HB/CE/PA/IT-PA-254476.pdf
- http://www.liofilchem.net/login/pd/ts/610363_TS.pdf
- https://www.msdmanuals.com/it-it/professionale/disturbi-dermatologici/acne-e-disturbi-correlati/acne-vulgaris
- https://healthjade.net/acne-fulminans/
- https://www.acne.org/what-is-acne-conglobata.html
- di Summa PG, Yvon A, Larcher L, Raffoul W, Koch N. 2015. “Propionibacterium avidum infection following breast reduction: high morbidity from a low-virulence pathogen”, J Surg Case Rep
- Kritikos A, Pagin M, Borens O, Voide C, Orasch C. 2015. “Identification of Propionibacterium avidum from a breast abscess: an overlooked etiology of clinically significant infections”, New Microbes New Infect
- Vohra A, Saiz E, Chan J, Castro J, Amaro R, Barkin J. 1998. “Splenic abscess caused by Propionibacterium avidum as a complication of cardiac catheterization”, Clin Infect Dis
- Vetromile F, Malfante P, Fuentes N, Bosio A. 2001. “Endocarditis bacteriana por Propionibacterium avidum: une primer caso en la literatura?” Rev Hosp Priv Comunidad
- Million M, Roux F, Cohen Solal J, Bréville P, Desplaces N, Barthas J, Nguyen Van J-C, Rajzbaum G. 2008. “Septic arthritis of the hip with Propionibacterium avidum bacteremia after intraarticular treatment for hip osteoarthritis”, Joint Bone Spine
- Drott JB, Alexeyev O, Bergström P, Elgh F, Olsson J. 2010. “Propionibacterium acnes infection induces upregulation of inflammatory genes and cytokine secretion in prostate epithelial cells”, BMC Microbiology
- Hoeffler U. 1977. “Enzymatic and hemolytic properties of Propionibacterium acnes and related bacteria”, Journal of Clinical Microbioliogy
- Kamil Piwowarek, Edyta Lipińska, Elżbieta Hać-Szymańczuk, Marek Kieliszek and Iwona Ścibisz. 2018. “Propionibacterium spp.—source of propionic acid, vitamin B12, and other metabolites important for the industry”, Appl Microbiol Biotechnol
- Angelopoulou A, Alexandraki V, Georgalaki M, Anastasiou R, Manolopoulou E, Tsakalidou E, Papadimitriou K. 2017. “Production of probiotic Feta cheese using Propionibacterium freudenreichii subsp. shermanii as adjunct”, International Dairy Journal
- Cousin FJ, Jouan-Lanhouet S, Théret N. 2016. “The probiotic Propionibacterium freudenreichii as a new adjuvant for TRAIL-based therapy in colorectal cancer”, Oncotarget
Fonti immagini
- https://anaerobicinfections.blogspot.com/2015/03/propionibacterium-acnes-emerging.html
- https://fineartamerica.com/featured/1-propionibacterium-acnes-bacteria-sem-scimat.html
- https://it.hiloved.com/la-nuova-scoperta-mostra-perche-il-formaggio-svizzero-ha-dei-buchi/
- https://www.arifmudi.id/propionibacterium-acnes-a-cause-of-your-acnes/
- http://www.davidebrunelli.it/cheloidi-e-cicatrici-ipertrofiche/
- https://itmedbook.com/tutto-cio-che-devi-sapere-sull-acne-cistica/https://www.mdpi.com/2076-2607/6/1/1/htm
- https://www.biomerieux-industry.com/pharma-healthcare/resources/pharma-microorganisms-library/2020-02-25-cutibacterium-acnes-gram