I peptidi antimicrobici
I peptidi antimicrobici (Antimicrobial Peptides, AMPs) sono delle molecole molto diffuse in natura. Si possono trovare, infatti, in qualunque essere vivente e hanno ruoli, principalmente, nell’ambito della difesa dell’ospite. Questi sono utili sia per contrastare le infezioni microbiche sia per eliminare le cellule cancerose. Il processo di difesa avviene grazie alla capacità di queste molecole di distruggere le membrane cellulari, portando la cellula alla morte.
Una particolarità di alcuni di questi peptidi è la capacità di formare strutture sovramolecolari, che permettono un miglior svolgimento della funzione antimicrobica. Queste strutture sovramolecolari sono le fibrille, tipiche delle proteine amiloidi. Nell’uomo, queste strutture sono tipiche di patologie neurodegenerative e sistemiche, prima fra tutte l’Alzheimer. L’individuazione di questa struttura potrebbe, quindi, suggerire come le proteine amiloidi possano avere un ruolo fisiologico nel nostro organismo: contrastare infezioni cerebrali!
La scoperta dell’uperina 3.5
I ricercatori del Technion – Israel Institute of Technology e dello European Molecular Biology Laboratory di Amburgo hanno individuato un nuovo peptide antimicrobico secreto dalla pelle del rospo australiano (Uperoleia mjobergii, Figura 1). Si tratta dell’uperina 3.5. Il loro studio è stato pubblicato sulla rivista Proceedings of the National Academy of Sciences, con il titolo “The Amphibian Antimicrobial Peptide Uperin 3.5 is a Cross-α/Cross-β Chameleon Functional Amyloid”. Come il titolo stesso suggerisce, lo studio si focalizza sulla particolare struttura che assume la molecola in presenza di batteri.

L’uperina 3.5, infatti, presenta una struttura secondaria camaleontica cross-α/cross-β, che le permette di cambiare conformazione in presenza di agenti patogeni. In questo modo conferisce una maggiore protezione al rospo. In particolare, i lipidi di membrana dei batteri favoriscono una transizione di struttura.
Uperina 3.5 e moduline fenolo-solubili (PSM)
Un’architettura simile a quella dell’uperina 3.5 era già stata precedentemente individuata nella famiglia di peptidi antimicrobici PSM (moduline fenolo-solubili), cioè la citotossina batterica PSMα3. Questa è secreta dal batterio Staphylococcus aureus ed è implicata nella virulenza del batterio, cioè la capacità di un batterio di eludere le difese immunitarie dell’ospite e causare danni all’organismo. Infatti, proprio PSMα3 ha un ruolo importante nella citotossicità verso le cellule del nostro sistema immunitario.
L’uperina 3.5 e la PSMα3 mostrano una bassa similarità di sequenza, ma presentano una struttura molto simile (Figura 2): entrambi contengono α-eliche, assemblate in modo da formare un foglietto. La differenza è che in un caso questi foglietti sono assemblati in maniera parallela (PMSα) e nell’altro in maniera antiparallela (uperina 3.5). In più, nel caso dell’uperina 3.5, la distanza tra i foglietti e tra le eliche è minore rispetto a quella della PSMα3.
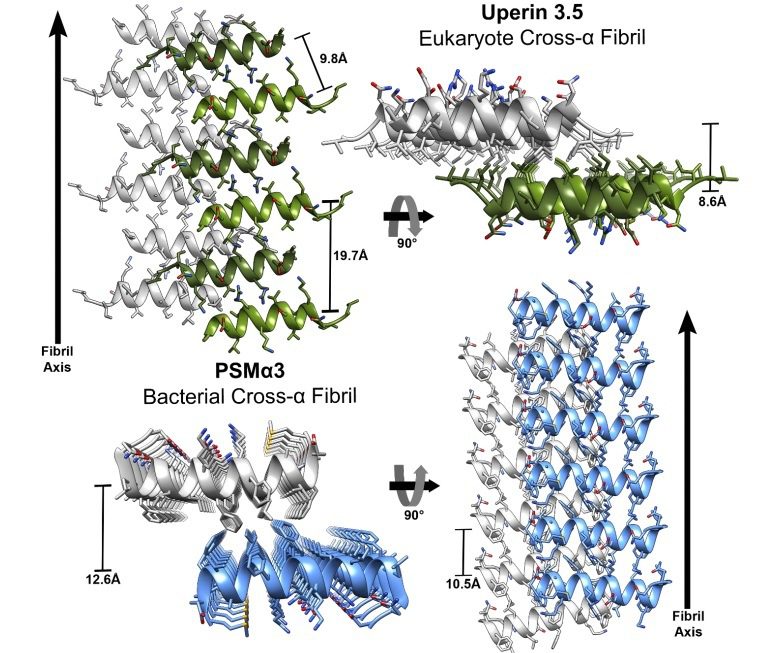
Uperina 3.5 e batteri
L’attività antimicrobica dell’uperina 3.5 è stata testata su quattro differenti batteri Gram-positivi: Micrococcus luteus, Staphylococcus hominis, Staphylococcus epidermis e Staphylococcus aureus. La molecola ha mostrato un’azione antimicrobica efficace principalmente nei confronti di M. luteus (Figura 3), rispetto a quanto osservato per gli altri tre batteri in esame.
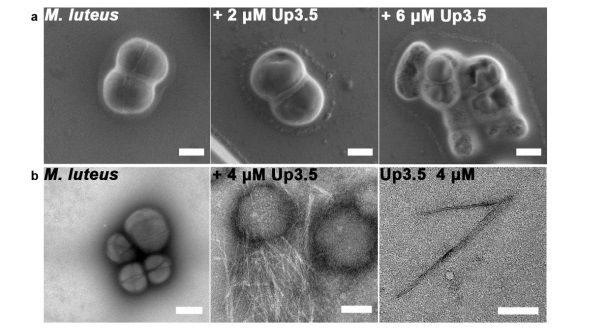
La presenza del batterio induce, quindi, un cambiamento conformazionale da cross-β fibrille a cross-α fibrille. Le prime sono meno tossiche per i patogeni, ma si trovano sulla pelle dell’animale per permettere un rapido cambiamento conformazionale e una rapida azione in caso di contatto con batteri. I ricercatori sono già a lavoro per identificare il meccanismo alla base di questa transizione.
Verso i futuri farmaci antimicrobici
Questo studio ha evidenziato quale sia la relazione tra peptidi antimicrobici e formazione di amiloidi. Infatti, i peptidi antimicrobici secreti dai batteri durante un’infezione e/o dalla microflora intestinale, potrebbero essere i responsabili dello sviluppo di patologie neurodegenerative o sistemiche. Saranno, però necessari ulteriori studi per chiarire il legame che c’è tra microbi, peptidi antimicrobici, sistema immunitario e patologie legate alle proteine amiloidi.
Sicuramente la scoperta, alla base di questo studio, potrà essere utilizzata, in futuro, per la creazione di peptidi sintetici con funzione di farmaci per trattare infezioni aggressive e/o batteri multi-resistenti, sempre più in aumento. Per fare questo, i ricercatori dovranno puntare su molecole con maggiore potenza, stabilità e biodisponibilità rispetto alle controparti naturali.
Emanuela Pasculli
Fonti
- “Bacteria “Croak” in the Presence of Toadlet Peptide” (15 gennaio 2021). Estrapolato da https://www.genengnews.com/topics/drug-discovery/bacteria-croak-in-the-presence-of-toadlet-peptide/;
- Salinas, Nir, et al. “The Amphibian Antimicrobial Peptide Uperin 3.5 is a Cross-α/Cross-β Chameleon Functional Amyloid.” bioRxiv (2020);
- Immagine in evidenza: http://www.broomebirdobservatory.com/news/2017/4/15/waterbirds-galore-at-the-bbo
- Figura 1: http://museum.wa.gov.au/explore/frogwatch/frogs/west-kimberley-toadlet
- Figure 2 e 3: https://www.pnas.org/content/118/3/e2014442118