I muscoli consumano energia
I muscoli dell’apparato locomotore supportano un’ampia varietà di attività dallo stare seduti al computer per ore ad attività fisiche intense e brevi come lo scatto di una corsa. Questo richiede un metabolismo energetico in grado di rispondere a diverse situazioni in modo immediato efficace. Infatti, i muscoli hanno la capacità di modulare il suo metabolismo energetico in base alle esigenze. In particolare, i muscoli sono composti da popolazioni eterogenee di cellule con distinte caratteristiche metaboliche e dotate di plasticità per rispondere a diversi stimoli.
Durante la contrazione muscolare viene consumata energia sotto forma di adenosina trifosfato (ATP), la moneta di scambio energetica della cellula. L’energia chimica contenuta nell’ATP viene convertita in energia meccanica; l’idrolisi (scissione in presenza di acqua) dell’ATP libera ADP (adenosina difosfato), un gruppo fosfato (Pi) ed energia.
Il metabolismo energetico
Nel muscolo, si nota che il contenuto cellulare di ATP resta relativamente costante, quindi c’è una corrispondenza tra l’energia prodotta e consumata. L’ATP prodotta viene immediatamente utilizzata. Il muscolo sintetizza ATP attraverso:
- Il metabolismo anaerobico nel breve periodo per sostenere attività fisiche intense e brevi;
- Il metabolismo aerobico nel lungo periodo per sostenere attività a bassa intensità e prolungate nel tempo .
Bisogna ricordare che ci sono molte situazioni intermedie tra questi due estremi e di conseguenza le vie metaboliche non sono fenomeni “tutto o niente”, ma i diversi pathways si sovrappongono. Questo implica uno stretto e rigido controllo del metabolismo energetico nel muscolo.

Il metabolismo anaerobico
Il metabolismo anaerobico consente di generare velocemente ATP per rispondere in modo immediato agli stimoli. ATP è sintetizzato partendo da substrati presenti nelle cellule muscolari attraverso tre meccanismi principali:
- Fosforilazione dell’ADP cellulare ad opera della adenilato chinasi;
- Degradazione della fosfocreatina (PCr);
- Glicolisi del glucosio mobilitato dal glicogeno o internalizzato dal circolo sanguineo.
Fosforilazione dell’ADP
La sintesi di ATP a breve termine è catalizzata dall’enzima adenilato chinasi (ADK) a partire da due molecole di ADP. L’enzima trasferisce un gruppo fosfato dalla prima molecola di ADP alla seconda per ottenere una molecola di ATP e una di AMP (adenosina monofosfato). In sintesi, ogni due molecole di ADP si forma una molecola di ATP. Questa reazione, oltre a contribuire alla sintesi di ATP, è un meccanismo per controllare lo stato energetico della cellula attraverso il rapporto tra ATP e ADP. Infatti piccoli cambiamenti nelle concentrazioni di ATP e ADP risultano in grandi cambiamenti di AMP. A sua volta, l’AMP agisce indirettamente sul metabolismo energetico del muscolo.
Degradazione della fosfocreatina
In risposta all’immediata richiesta di ATP, la fosfocreatina (PCr) è degradata. La sua degradazione è mediata dall’enzima creatina chinasi (CK) che trasferisce un gruppo fosfato da PCr ad ADP per formare cretina (Cr) e ATP. Per ogni molecola di PCr si forma una molecola di ATP. Durante la contrazione, PCr viene velocemente consumata mentre l’ATP appena formato è istantaneamente convertito in ADP e Pi. Quindi si ha un accumulo di Cr e Pi. Dopo lo sforzo, nel periodo di recupero, l’ATP non è più consumato e aumenta la sua concentrazione. Questa condizione favorisce la formazione PCr ad opera della creatina chinasi che trasferisce il gruppo fosfato da ATP a Cr.
Glicolisi
La glicolisi converte il glucosio in piruvato e produce ATP in modo veloce e in assenza di ossigeno. Per ogni molecola di glucosio si formano due molecole di piruvato, due di ATP e due di NADH+H+. Il glucosio può derivare dal glicogeno immagazzinato nel muscolo. La degradazione del glicogeno (glicogenolisi) è catalizzata dall’enzima glicogeno fosforilasi, la cui attività è regolata con meccanismi molto fini e non del tutto chiari. Alternativamente, il glucosio è internalizzato dal circolo sanguineo attraverso recettori specifici, anche in questo caso l’uptake è strettamente controllato.
Oltre alla sintesi di ATP, la glicolisi comporta la riduzione di NAD+ a NADH+H+. Questo cofattore è presente in quantità limitata all’interno della cellula e deve essere ossidato a NAD+ per essere nuovamente disponibile. Nel muscolo, in assenza di ossigeno (condizioni anaerobiche) il cofattore è ossidato riducendo il piruvato in lattato (acido lattico) dall’enzima lattato deidrogenasi (LDH). Successivamente, il lattato è poi trasferito dal muscolo al fegato per essere utilizzato nella gluconeogenesi (ciclo di Cori).

Il metabolismo aerobico
Il metabolismo aerobico sostiene sforzi muscolari prolungati nel tempo producendo ATP in presenza di ossigeno. Vari substrati possono sostenere questo metabolismo:
- Il glucosio mobilitato dal glicogeno ed extracellulare;
- Gli acidi grassi liberi derivati dai trigliceridi del muscolo o del tessuto adiposo;
- Gli amminoacidi derivati dalla degradazione di proteine.
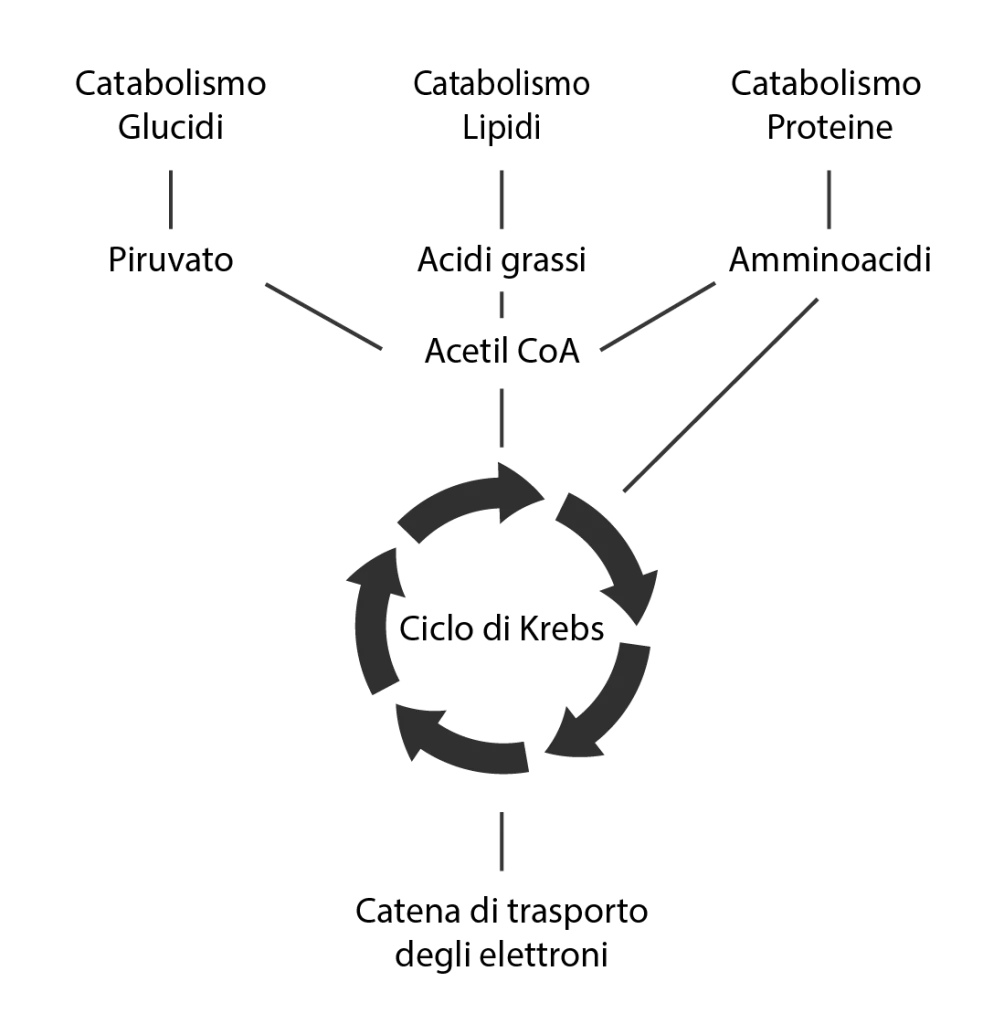
Queste molecole, dopo essere convertite da alcune reazioni, alimentano il ciclo di Krebs (ciclo degli acidi tricarbossilici, TCA cycle). In particolare, il piruvato derivato dalla glicolisi è convertito in acetil-coenzima A (Acetil-CoA) dalla piruvato deidrogenasi (PDH). Anche gli acidi grassi liberi sono demoliti dal pathway della β-ossidazione in Acetil-CoA. L’Acetil-CoA è poi trasportato nella matrice mitocondriale dove ha luogo il ciclo di Krebs. Il ciclo degli acidi tricarbossilici, per ogni molecola di Acetil-CoA, sintetizza una molecola di ATP, una di GTP che è facilmente convertita in ATP, e riduce di 3 molecole di NAD+ a NADH+H+ e una di FAD a FADH2. Al contrario di glucosio e lipidi, le proteine vengono prima demolite nei singoli amminoacidi e quest’ultimi vanno incontro a reazioni specifiche per entrare nel ciclo di Krebs.
Alla fine del ciclo di Krebs, gli equivalenti riducenti prodotti (i cofattori ridotti NADH+H+ e FADH2) sono ossidati nella catena di trasporto degli elettroni. Grazie a una serie di ossidoriduzioni, gli elettroni sono trasportati da complesso a complesso e infine sono ceduti all’ossigeno, mentre i protoni (H+) sono trasportati dalla matrice mitocondriale allo spazio intermembrana. Si crea un gradiente elettrochimico che è sfruttato dall’enzima ATP sintasi per sintetizzare ATP a partire da ADP e Pi, mentre i protoni ritornano nella matrice mitocondriale.
Fonti
- Zumbaugh MD, Johnson SE, Shi TH, Gerrard DE. Molecular and biochemical regulation of skeletal muscle metabolism. J Anim Sci. 2022 Aug 1;100(8):skac035. doi: 10.1093/jas/skac035. PMID: 35908794; PMCID: PMC9339271.
- Frontera WR, Ochala J. Skeletal muscle: a brief review of structure and function. Calcif Tissue Int. 2015 Mar;96(3):183-95. doi: 10.1007/s00223-014-9915-y. Epub 2014 Oct 8. PMID: 25294644.
- Westerblad H, Bruton JD, Katz A. Skeletal muscle: energy metabolism, fiber types, fatigue and adaptability. Exp Cell Res. 2010 Nov 1;316(18):3093-9. doi: 10.1016/j.yexcr.2010.05.019. Epub 2010 May 24. PMID: 20580710.
Crediti immagini
- Immagine in evidenza: https://www.gibaud.it/come-sono-fatti-i-muscoli-in-viaggio-nel-corpo-umano/
- Figura 1: https://www.accademiadeitest.it/blog/materie/biologia/atp-molecola-biologia-metabolismo-cellulare/
- Figura 2: https://www.fidal.it/upload/Trentino/Struttura%20Tecnica/Corso%20Istruttori/20160324090650_Lezione_Corso_Benedetti_2016_primaparte.pdf
- Figura 3: https://www.adessosport.com/il-metabolismo-aerobico/