Caratteristiche
Cladosporium cladosporioides (Fig. 1) è una muffa dematiacea (cioè caratterizzata dalla presenza di pigmentazione melaninica nella componente vegetativa e conidiale) che cresce in tutto il mondo su una vasta gamma di materiali, sia negli spazi aperti che in quelli chiusi, di frequente si trova come contaminante nel cibo, e raffigura uno dei funghi più comuni nell’ambiente esterno dove le sue spore giocano un ruolo cruciale nelle malattie allergiche. A proposito delle spore, va sottolineato come l’estate rappresenti il periodo in cui esse raggiungono un picco variabile da 2000 a 50000 per metro cubo d’aria.

In interni C. cladosporioides può proliferare su multipli substrati, inclusi carta, pasta di legno, vernici, affreschi, piastrelle, davanzali bagnati, cibi salati o zuccherosi, e fibre tessili (seta e cotone), e spesso è associata con la crescita di altre specie fungine (Penicillium, Aspergillus versicolor e Wallemia sebi). Peraltro predilige zone umide come edifici in cui la concentrazione di vapore acqueo è maggiore del 50%, cantine e sotterranei, imbottiture di tappeti, costruzioni eccessivamente esposte all’umidità ed edifici scarsamente ventilati.
All’aperto il micete colonizza la materia organica, il terreno ed è stato trovato in varie coltivazioni, tra cui grano, uva, fragole, piselli e spinaci. Come gli altri funghi del genere Cladosporium, raramente causa malattie invasive negli animali, ma è un agente importante delle patologie nelle piante, nelle quali attacca sia le foglie che i frutti.
C. cladosporioides fu descritto per la prima volta nel 1850 da parte del botanico e medico tedesco Johann Baptist Georg Wolfgang Fresenius, il quale lo classificò all’interno del genere Penicillium, chiamandolo quindi Penicicllium cladosporioides. Nel 1880 il botanico e micologo italiano Pier Andrea Saccardo rinominò il micete Hormodendrum cladosporioides. Infine nel 1952 il botanico olandese Gerardus Albertus de Vries trasferì la specie nel genere Cladosporium, all’interno del quale questo fungo è rimasto fino ai giorni nostri.
C. cladosporioides è un abituale saprofita che provoca infezioni secondarie su parti di piante, in decomposizione o necrotiche. Si tratta di un fungo xerofilico e psicrofilo, ovvero cresce bene in ambienti con limitate quantità d’acqua e a temperature molto basse (tra -10°C e -3°C) rispettivamente. Proprio a causa della sua tolleranza verso il freddo, riesce a crescere su cibi refrigerati e a colonizzare le superfici umide dei frigoriferi.
Filogenesi
Dominio Eukaryota
Regno Fungi
Phylum Ascomycota
Classe Dothideomycetes
Ordine Capnodiales
Famiglia Davidiellaceae
Genere Cladosporium
Specie C. cladosporioides
Morfologia e ciclo vitale
C. cladosporioides si riproduce in maniera asessuata e, poiché non è stata identificata alcuna produzione di ascospore, viene considerato un micete esclusivamente anamorfo. Questo termine (dal greco anamorfòo, che vuol dire “dare nuova forma”) indica la forma conidiofora, ossia definita dalla riproduzione mediante spore asessuate, contrariamente ai funghi teleomorfi (dal greco tèlos o tèleos, che significa “pieno sviluppo”, “compimento”) che rilasciano spore sessuate.
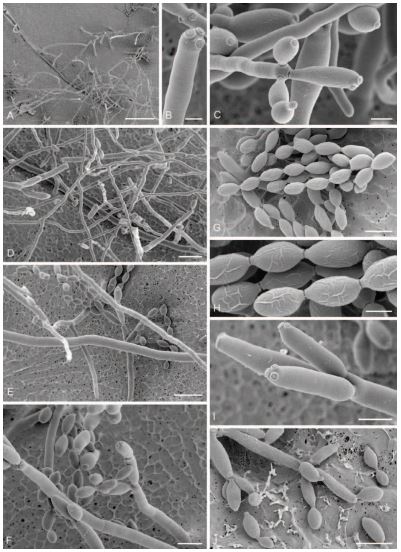
I conidiofori si formano alla fine delle ife ascendenti, le quali sostengono le catene di conidi ai livelli laterale e terminale; i conidi sono contraddistinti da una forma ellissoidale o cilindrica, una superficie liscia (Fig. 3G, 3H, 3J), il colore olivaceo, marrone scuro o pallido, e si liberano facilmente (Fig. 2); inoltre forgiano catene lunghe e fragili di dieci spore (Fig. 2A), tra le quali è presente un tessuto connettivo scuro distintivo.
Le ife sono settate, rade, non ramificate o poco ramificate (Fig. 2), scure e generalmente non sono compresse a livello dei setti (Fig. 3C, 3D, 3F). I conidiofori maturi ricordano un albero e comprendono lunghe catene ramificate di conidi (Fig. 2C, 2D); il C. cladosporioides crea dei conidiofori solitari marroni o marroni-olivastri, cilindrici, che si ramificano in modo irregolare, creando un cospicuo numero di diramazioni (Fig. 2D). Ogni propaggine ha una lunghezza tra 40 e 300 µm (in casi eccezionali anche 350 µm) e una larghezza di 2-6 µm.
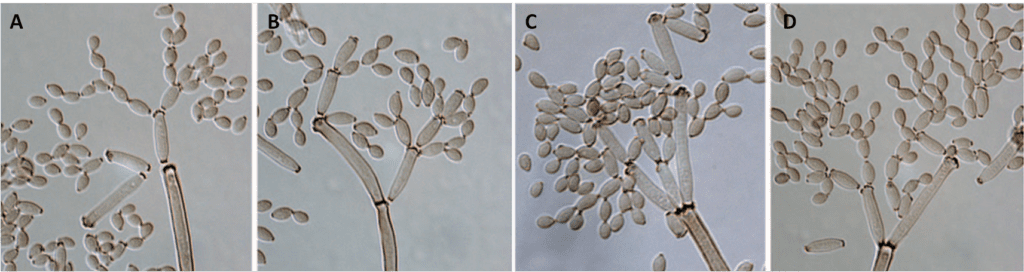
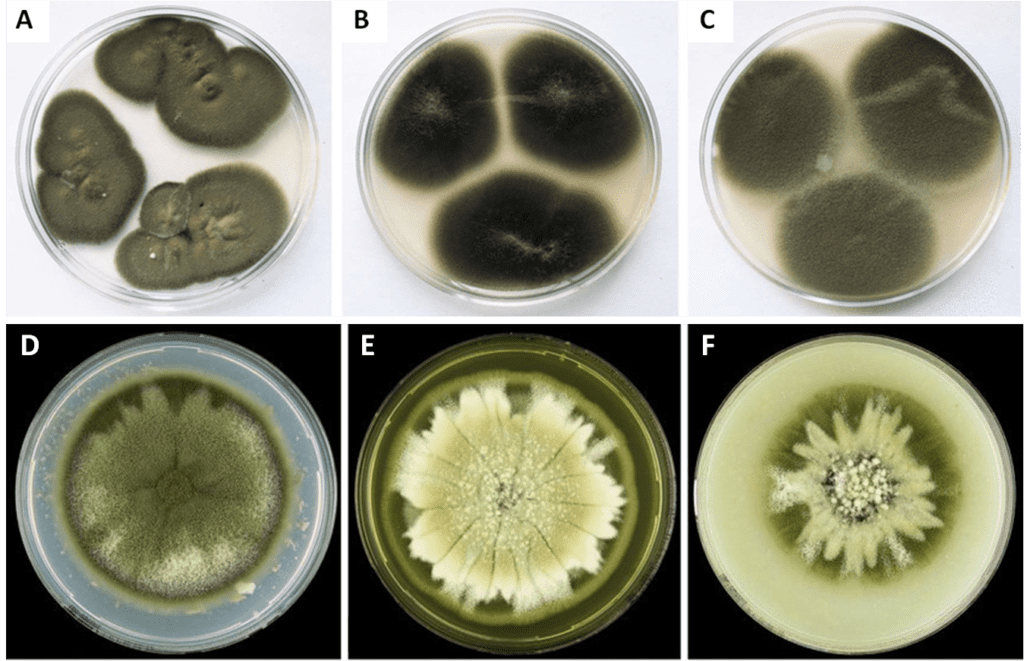
Per quanto concerne la morfologia delle colonie di C. cladosporioides, queste possono essere studiate seminando il micete su tre specifici terreni di coltura, ossia Potato dextrose agar (PDA), Malt extract agar (MEA) e Oatmeal agar (OA). Sul PDA le colonie appaiono grigie-olivastre, o di un verde sbiadito, dall’aspetto vellutato e a ciuffi; i margini possono essere grigio-olivastri o bianchi, e piumosi. Le colonie sono estese, il micelio crea dei grovigli e raramente cresce verso l’alto dalla superficie della colonia (Fig. 4A). Sul MEA i pigmenti delle colonie vanno da grigio-olivastro a olivastro, oppure biancastro a causa del micelio che si eleva verso l’alto. Questo può essere sparso o a ciuffi, con i bordi neri-olivastri o marroni-olivastri, e qualche volta copre l’intera colonia (Fig. 4B). Infine sull’OA le colonie sono caratterizzate da un gradiente di colori dal centro verso i confini che va dal verde oliva al verde smorto, poi grigio-olivastro, qualche volta bianco. La crescita del micelio verso l’alto può variare da scarsa a sovrabbondante e a ciuffi; esso può essere sciolto o compatto e tende a crescere in maniera monotona (Fig. 4C).
Patogenesi
C. cladosporioides di rado si comporta come un agente patogeno negli esseri umani, occasionalmente determina feoifomicosi polmonari o cutanee e nel 2002 è stato isolato da tre campioni di liquido cerebrospinale in un individuo immunodepresso.
In esperimenti sui topi, si è visto che le spore di C. cladosporioides inducono iperreattività dei polmoni, come anche un aumento dei granulociti eosinofili, un tipo di globuli bianchi che intervengono nelle allergie e nelle infezioni da elminti. C. cladosporioides può provocare anche infiammazioni respiratorie a causa dell’up-regolazione di due citochine, ovvero la chemochina CXCL2 (chiamata anche proteina infiammatoria dei macrofagi 2α), che richiama i granulociti neutrofili, e l’interleuchina 8, che agisce come chemoattrattore dei charatinociti.
Uno studio del 2008, pubblicato su Journal of Comparative Pathology, ha descritto un caso di encefalite granulomatosa e nefrite dovute a C. cladosporioides in un cane, i cui sintomi erano comportamento alterato, depressione, riflessi anormali e perdita della visione. L’esame post-mortem indicò lesioni a livello del tronco encefalico posteriore e del cervelletto; sui tessuti furono effettuate la colorazione immunoistochimica e l’amplificazione del DNA mediante semi-nested PCR, che confermarono il coinvolgimento del micete.
I miceti del genere Clasporium spp. raffigurano un allergene tanto comune quanto importante, relazionato sia con le allergie di tipo I (mediate da immunoglobuline di tipo E, come febbre da fieno e asma) che con quelle di tipo III (mediate da immunocomplessi, come le polmoniti da ipersensibilità). Il fungo viene riconosciuto come un abituale induttore di riniti allergiche e asma negli esseri umani; le reazioni asmatiche sono dovute alla presenza di beta-glucani sulla superficie delle spore, che vengono riconosciuti dal recettore Dectin-1 (o membro A della famiglia di dominio 7 della lecitina di tipo C), espresso su cellule dendritiche, monociti, macrofagi e linfociti B.
Sono stati condotti numerosi studi al fine di stabilire il collegamento tra la presenza di Cladosporium negli spazi interni o esterni e la sensibilizzazione dei soggetti esposti. Nonostante i risultati varino grandemente da studio a studio, molti di essi mostrano tale associazione persino quando le concentrazioni di Cladosporium in interni sono basse.
Normalmente Cladosporium si trova nelle case di soggetti sensibilizzati; la prevalenza della sensibilizzazione può raggiungere il 92% nei pazienti sensibilizzati verso la muffa che vengono colpiti da allergie stagionali. La sensibilizzazione verso Cladosporium è stata positivamente connessa con l’asma allergica. Tuttavia, in alcuni casi la presenza di Cladosporium non è correlata con i sintomi degli abitanti esposti.
Si è scoperto che Cladosporium, insieme ad altre muffe, è coinvolto nell’eziologia delle rinosinusiti croniche, ed è stato individuato nel muco nasale di pazienti che soffrono di tali patologie. In aggiunta a ciò, gli scienziati hanno dimostrato una forte associazione tra la sensibilizzazione con le IgE nei pazienti eczematosi e l’esposizione a Cladosporium.
Nelle investigazioni riguardanti i fattori di rischio connessi con l’iperreattività bronchiale legata all’asma e alle malattie polmonari ostruttive croniche, Chinn S. et al. (in un lavoro del 1998) identificarono l’acaro della polvere Dermatophagoides pteronyssinus e la muffa Cladosporium come i fattori che incrementano la risposta mediata dalle IgE.
Nel 2002 Jacob B. et al. condussero uno studio su una popolazione di 370 bambini atopici o allergici, e constatarono che le conte delle spore per Cladosporium e Aspergillus erano correlate con un aumentato rischio di sensibilizzazione allergica. Uno studio effettuato su 105 pazienti asmatici in Polonia (Niedoszytko, M et al., 2007) ha rivelato che la sensibilizzazione a Cladosporium era rapportata con la gravità dell’asma, insieme a molte altre muffe (Alternaria, Aspergillus, Penicillium, Trichothecium, Chaetomium globosum, Epicoccum, Epidermophyton, Helminthosporium, Aureobasidium pullulans, Rhizopus nigricans, Fusarium, Mucor, Merulius lacrymans). Infine, uno studio australiano del 2005 (Matheson M. et al.) ha evidenziato che il raddoppio dell’esposizione al Cladosporium comporta un incremento del 52% di probabilità di avere un attacco di asma.
Nella valutazione dell’effetto dell’umidità nelle abitazioni sugli episodi di asma, Norback et al., in un lavoro del 1999, svelarono che la reazione di ipersensibilità immediata (di tipo I) a Cladosporium era maggiormente prevalente nelle abitazioni umide (9,3% vs 3,9%) ed era relazionata con l’asma attuale.
È stato documentato un limitato numero di casi di polmoniti da ipersensibilità (alveoliti allergiche) dovute all’esposizione a Cladosporium, molti dei quali erano connessi con gli umidificatori o con gli ambienti assai umidi come spazi ristretti contenenti vasche idromassaggio.
In uno studio del 1995, Suda T. et al. hanno descritto cinque pazienti affetti da polmonite da ipersensibilità associata agli umidificatori a ultrasuoni; nonostante Cladosporium sia stato isolato dall’acqua degli umidificatori, l’incidenza della positività agli immunocomplessi specifici per questo fungo nei pazienti era bassa.
In uno studio riguardante due casi di polmonite da ipersensibilità correlata a Cladosporium in ambienti domestici, i ricercatori notarono che l’attività stimolante dei linfociti e il titolo anticorpale verso C. cladosporioides e C. herbarum presentavano un maggiore incremento nei due pazienti oggetto d’esame. Questi risultati sono particolarmente significativi, poiché a volte i casi di polmonite da ipersensibilità sono difficili da diagnosticare a causa degli agenti ubiquitari e alla mancanza nei pazienti di una storia chiara di esposizione all’antigene. È importante anche rimarcare che un’alta concentrazioni di anticorpi anti-Cladosporium da sola non è sufficiente per diagnosticare la polmonite da ipersensibilità legata a tale micete.
Anche se molte specie di Cladosporium non sono patogene, sono stati riportati alcuni casi di infezioni opportunistiche dovute a questo fungo caratterizzate da lesioni cutanee, cheratiti, onicomicosi, sinusiti e infezioni polmonari. C. cladosporioides è un saprofita ampiamente distribuito che occasionalmente infetta polmoni, cute, occhi e cervello negli esseri umani.
Gli individui severamente immunodepressi, per esempio quelli affetti da malattie ematologiche maligne, coloro che subiscono il trapianto di cellule staminali ematopoietiche e i pazienti che ricevono la terapia citotossica post-trapianto, rappresentano una popolazione a rischio per infezioni fungine, incluse quelle da Cladosporium spp.
C’è da dire che una quantità alquanto ristretta di specie di Cladosporium è stata messa in relazione con le infezioni, e che tra le specie saprofite comuni, il C. cladosporioides è considerato un raro agente opportunista.
In due studi pubblicati su Mycoses (Annessi G. et al., 1992 e Gugnani H. C. et al., 2002) gli scienziati hanno esposto degli episodi di feoifomicosi superficiali e sottocutanee provocate da C. cladosporioides in individui apparentemente sani. Nel progetto di Annessi la patologia fu descritta su un uomo di 54 anni che presentava lesioni papulari marroni-rossicce su ginocchia e cosce. La biopsia cutanea rivelò un infiltrato granulomatoso con numerosi elementi fungini sparsi nel derma, e anche all’interno di cellule giganti; la coltura dei frammenti cutanei su agar Sabouraud destrosio in presenza di cloramfenicolo diede come risultato la crescita di colonie verdi scure a 25° C, che furono identificate come C. cladosporioides. Nell’articolo di Gugnani l’infezione venne esaminata su un uomo di 25 anni che mostrava una lesione squamosa suppurativa con cavità sulla gamba destra; tale lesione guarì completamente in seguito alla terapia con fluconazolo orale. Questo paper costituisce il primo record di infezione cutanea e sottocutanea da C. cladosporioides dall’India.
Il C. cladosporioides è stato riportato in alcuni ambienti occupazionali dove c’è una quantità rilevante di polvere organica dispersa nell’aria (industrie di legno e cotone, fornai, depositi di cereali) e in ambienti altamente impregnati (aree circoscritte con vasche idromassaggio). In questi ambienti, i lavoratori a rischio possono sviluppare in maggior misura la sensibilizzazione allergica e le reazioni allergiche a livello dell’apparato respiratorio.
Nei campioni di cotone raccolti da diverse aree del mondo, Cladosporium era presente in sette campioni su tredici, ed era la specie dominante in quattro di essi. In uno studio di Guerrera E. et al. del 2006 Cladosporium risultò tra i funghi predominanti identificati durante la normale attività all’interno delle segherie umbre.
Nelle panetterie industriali o simil-domestiche, gli episodi di Cladosporium furono documentati tra il 21,9% e il 29,5%, e tale micete era il secondo tra le specie isolate più sovente, dopo Penicillium. Inoltre, alte concentrazioni di questi funghi furono descritte nel 2000 in un panificio rurale del Bengala Occidentale, in India; qui i funghi dominanti erano C. cladosporioides, Aspergillus niger, Aspergillus flavus, Aspergillus fumigatus, Penicillium citrinum e Alternaria alternata.
Nelle aree rurali, le specie fungine costituiscono uno dei maggiori componenti dei contaminanti ambientali all’interno di strutture dove sono presenti animali. Nelle misture di nutrimenti per pollame, i ricercatori hanno individuati C. cladosporioides con una frequenza del 31%, anche se non c’era alcuna associazione alle micotossine. In Lituania, C. cladosporioides e C. herbarum furono isolati da svariati ambienti industriali, inclusi un pollaio, una dispensa, un mulino per cereali, una fabbrica di produzione di pannelli di legno e strutture di riciclaggio di scarti organici. Tali specie raffiguravano di solito dall’1,4% al 6% di tutte le specie isolate, eccetto per un’alta frequenza di C. cladosporioides (17%) in un mulino per cereali.
Dal momento che C. cladosporioides è un agente rilevante nelle patologie delle piante, prima di concludere è opportuno fornire una descrizione delle malattie indotte da questo micete sui vegetali. C. cladosporioides, ma anche C. herbarum, sono responsabili della putrefazione della vite del vino rosso (Vitis vinifera), caratterizzata da sintomi come disidratazione, formazione di una piccola area di marciume e di uno strato di muffa di colore grigio-olivastro (Fig. 5). Tali segni si osservano sui chicchi maturi.

Il micete è coinvolto anche nella decomposizione dei fiori delle fragole, in cui le zone colpite sono le antere, i sepali, i petali e il pistillo. L’infezione induce la necrosi dell’intero fiore, o parte di esso, la produzione di frutti piccoli e deformi, e la sporulazione grigio-verdastra sullo stigma. Quest’infezione si verifica con maggiore frequenza nelle piante di fragole coltivate in esterno che in quelle presenti nelle serre.
Per completare questa parte, vorrei citare una review che documenta il primo caso di infezione da C. cladosporioides sulle piante di pomodori in Messico (Leticia Robles-Yerena et al., 2019). Nella serra di pomodori di Texcoco, nel 2017, si riscontrarono delle lesioni gialle irregolari sulla superficie adassiale delle foglie; sul lato inferiori delle lesioni, invece, si era sviluppata una sporulazione di un intenso colore marrone-grigiastro. Il patogeno fu isolato su PDA e le colonie esibivano un micelio aereo rado, il cui colore andava dal marrone-olivaceo al marrone, con una trama vellutata e una sporulazione copiosa. I conidiofori erano solitari, dritti o leggermente ricurvi, marroni-olivacei, cilindrici, non ramificati od occasionalmente ramificati. I conidi erano marroni-olivacei, lisci, e formavano lunghe catene; i conidi intercalari erano a forma di limone o a volte subcilindrici, non settati. Considerando le caratteristiche morfologiche, il fungo venne riconosciuto come C. cladosporioides.
Approcci diagnostici
Poiché C. cladosporioides non è considerato un agente infettivo, le colture in genere non sono garantite. Peraltro, la maggioranza degli casi clinici isolati di questo genere di funghi raffigura la colonizzazione delle zone non sterili del corpo. I saprofiti del genere Cladosporium sono tra i più comuni contaminanti dematiacei trovati nei laboratori clinici. Di conseguenza, per confermare l’eziologia di un infezione da Cladosporium, è necessaria una coltura positiva da un sito normalmente sterile accoppiata all’evidenza istopatologia.
Gli esami istopatologici non rivelano specifiche caratteristiche patognomoniche, e l’aspetto dei tessuti infetti può ricordare altre feoifomicosi con ife scure. C’è stato un caso (che abbiamo già accennato nella patogenesi) in cui una biopsia cutanea presentava un infiltrato granulomatoso contenente una notevole quantità di ife scure disseminati nel derma. La specie di micete era stata poi accertata tramite coltura su agar Sabouraud destrosio.
Per la diagnosi dell’allergia da Cladosporium spp., è possibile basarsi sui sintomi dell’asma che seguono variazioni stagionale nelle conte delle spore del micete, e sulla dimostrazione della reattività degli anticorpi IgE. Al fine di individuare la reattività delle IgE, si esegue il test allergologico cutaneo chiamato prick test usando un estratto purificato del fungo. Questo approccio è raccomandato come screening primario, in quanto raramente dà dei falsi negativi. Per quanto riguarda il saggio di radioallergoassorbimento (RAST), può essere negativo nel 20-30% dei pazienti allergici ma raramente comporta dei falsi positivi.
Gli estratti di C. cladosporioides sono disponibili in una mistura fungina per il test cutaneo. Gli allergeni di Cladosporium rientrano nel programma di sorveglianza della Food and Drug Administration (FDA) e nella lista di muffe del Biological Product Deviation Reports (BPDR).
Gli estratti allergenici di Cladosporium spp. elencati dalla FDA sono i seguenti:
- GJ39 (C. cladosporioides)
- GJ40 (C. fulvum)
- GJ41 (C. herbarum )
- GJ42 (C. werneckii)
Capacità antifungine
Secondo un lavoro pubblicato nel 2017 su PLOS ONE, C. cladosporioides e C. pseudocladosporioides possiedono una peculiare abilità antifungina verso Puccinia horiana, un fungo appartenente al phylum Basidiomycota responsabile della ruggine bianca del crisantemo. Questa malattia è contraddistinta dalla genesi di macchie sulla superficie superiore delle foglie; all’inizio sono verdi pallide o gialle, per poi cambiare verso il marrone in seguito alla necrosi del tessuto. Sul lato inferiore delle foglie la macchie si trasformano in pustole rosa o bianche che diventano prominenti nel momento in cui si sviluppano le teliospore (chiamate anche teleutospore, delle spore a riposo da cui deriva il basidio).
Funghi isolati da pustole di ruggine presenti sulle piante di una serra commerciale di Villa Guerrera, in Messico, furono identificati come C. cladosporioides e C. pseudocladosporioides grazie ad analisi molecolari e morfologiche. Questi isolati fungini vennero impiegati nel progetto al fine di studiare l’antagonismo dei due miceti su P. horiana. I ricercatori osservarono che le due specie di Cladosporium crescevano verso le teliospore della ruggine bianca e colonizzavano le cellule sporigene, anche se non avveniva una penetrazione diretta delle teleutospore. In ogni caso, il citoplasma e la struttura di esse erano alterate.
Il saggio dell’antagonismo rivelò che se le teliospore di P. horiana erano trattate solamente con acqua, non subivano alcuna alterazione (Fig. 6A1 e 6B1). Tra l’altro non si notavano conidi o ife di C. cladosporioides o C. pseudocladosporioides sulle superfici delle foglie inoculate nelle aree prive di pustole di P. horiana (Fig. 6A2 e 6B2). Invece, 96 ore dopo l’inoculazione con Cladosporium, le pustole assumevano un aspetto simile a quello osservato sulle foglie provenienti dalle piante malate raccolte nella serra commerciale di Villa Guerrero (Fig. 6A3 e 6B3).
Da queste ricerche si rese noto che i due Cladoporium esibiscono un significativo parassitismo sulle pustole di P. horiana (Fig. 7).


In aggiunta a ciò, gli scienziati constatarono che i due funghi del genere Cladosporium erano in grado di crescere su terreni contenenti il polisaccaride laminaria come unica fonte di carbonio. Se invece la sorgente di carbonio era la chitina, la crescita non avveniva, e ciò suggerì la capacità dei miceti di produrre le β-1,3 glucanasi (questo perché tali enzimi scindono i legami β-1,3 glicosidici, diversi da quelli presenti nella chitina, che sono β-1,4 glicosidici).
Fonti
- https://blog.microbiologics.come/environmental-isolates-case-file-cladosporium-cladosporioides/
- K. Bensch, J.Z. Groenewald, J. Dijksterhuis, M. Starink-Willemse, B. Andersen, B.A. Summerell, H.-D. Shin, F.M. Dugan, H.-J. Schroers, U. Braun8 and P.W. Crous . 2010. “Species and ecological diversity within the Cladosporium cladosporioides complex (Davidiellaceae, Capnodiales)”, Studies in Micology
- Chinn S., Jarvis D., Luczynska C., and Burney P. 1998. “Individual allergens as risk factors for bronchial responsiveness in young adults”, Thorax.
- Poutahidis T., Angelopoulou K., Karamanavi E., Polizopoulou Z. S., Doulberis M., Latsari M., Kaldrymidou E. 2009. “Mycotic encephalitis and nephritis in a dog due to infection with Cladosporium cladosporioides”, Journal of Comparative Pathology
- Jacob B., Ritz B., Gehring U., Koch A., Bischof W., Wichmann H. E., and Heinrich, J. 2002. “Indoor exposure to molds and allergic sensitization”, Environ Health Perspect.
- Niedoszytko M., Chelminska M., Jassem E., and Czestochowska E. 2007. “Association between sensitization to Aureobasidium pullulans (Pullularia sp) and severity of asthma”, Ann Allergy Asthma Immunol.
- Norback D., Bjornsson E., Janson C., Palmgren U., and Boman G. 1999. “Current asthma and biochemical signs of inflammation in relation to building dampness in dwellings”, Int J Tuberc. Lung Dis.
- Suda T., Sato A., Ida M., Gemma H., Hayakawa H., and Chida K. 1995. “Hypersensitivity pneumonitis associated with home ultrasonic humidifiers”, Chest
- Annessi G., Cimitan A., Zambruno G., and Di, Silverio A. 1992. “Cutaneous phaeohyphomycosis due to Cladosporium cladosporioides”, Mycoses
- Gugnani H. C., Sood N., Singh B., and Makkar R. 2000. “Case report. Subcutaneous phaeohyphomycosis due to Cladosporium cladosporioides”, Mycoses
- Guerrera E., Frusteri L., Giovinazzo R., Mariani M., and Pitzurra L. 2006. “Presence of the microbiological risk in Umbrian sawmills”, G. Ital. Med Lav. Ergon
- Adhikari A., Sen M. M., Gupta-Bhattacharya S., and Chanda S. 2000. “Incidence of allergenically significant fungal aerosol in a rural bakery of West Bengal, India”, Mycopathologia
- Leticia Robles-Yerena, Victoria Ayala-Escobar, Santos Gerardo Leyva-Mir, Nelson Bernardi Lima, Moisés Camacho-Tapia, and Juan Manuel Tovar-Pedraza. 2019. “First report of Cladosporium cladosporioides causing leaf spot on tomato in Mexico”, Journal of Plant Pathology
- Rachael A. Mintz-Cole, Eric B. Brandt, Stacey A. Bass, Aaron M. Gibson, Tiina Reponen, and Gurjit K. Khurana Hershey, MD. 2013. “Surface availability of beta-glucans is critical determinant of host immune response to Cladosporium cladosporioides”, Journal of Allergy and Clinical Immunology
- B. A. Latorre, E. X. Briceño, R. Torres. 2010. “Increase in Cladosporium spp. populations and rot of wine grapes associated with leaf removal”, Crop Protection
- David Eduardo Torres, Reyna Isabel Rojas-Martìnez, Emma Zavaleta-Mejìa, Patricia Guevara-Fefer, G. Judith Màrquez-Guzmàn, Carolina Perez-Martìnez. 2017. “Cladosporium cladosporioides and Cladosporium pseudocladosporioides as potential new fungal antagonists of Puccinia horiana Henn., the causal agent of chrysanthemum white rust”, PLOS ONE
Un articolo molto ben fatto! Grazie..