Introduzione alla terapia genica
Le nuove frontiere della scienza stanno, da tempo, rivolgendo l’attenzione all’applicazione delle strategie di terapia genica. Le terapie avanzate sono intese come l’insieme degli approcci clinici, che si fondano sull’utilizzo di farmaci biologici. Alla base di questa innovativa concezione di medicina c’è l’impiego di acidi nucleici, cellule e tessuti a scopo terapeutico. Tutti i prodotti che rispecchiano le caratteristiche citate sono accomunati dall’acronimo ATMPs (Advanced Therapy Medicinal Products).
Nella trattazione dell’argomento scelto per l’articolo si pone particolare attenzione ai medicinali per terapia genica strettamente detti; questi ultimi prevedono l’inserimento di una copia corretta del gene o la modifica del corredo genetico, mediante l’introduzione di acidi nucleici terapeutici (RNA e DNA).
L’acido nucleico di interesse può essere introdotto nel target sotto forma di:
- Oligonucleotidi, corte sequenze non codificanti
- Sequenze geniche, in forma di cDNA o mRNA codificanti per un prodotto proteico
- DNA in costrutti plasmidici o vettori virali
- Analoghi degli acidi nucleici, molecole che ne conservano le proprietà basilari ma che possiedono una struttura chimica differente
- Molecole di sintesi come gli “aptameri”
Le linee d’azione che possono essere seguite per il conseguimento dello scopo prefissato dalla terapia genica, sono molteplici e classificabili in quattro sottogruppi di strategie:
- Sostitutive, prevedono di ricostituire l’espressione di un gene l’assenza del cui prodotto è alla base della patologia.
- Additive, lo scopo è fornire al bersaglio dei geni che conferiscono delle funzioni nuove e migliorative.
- Riparative, si effettuano solitamente in patologie genetiche ereditarie e mirano alla correzione del difetto genico agendo in modo diretto sul genoma cellulare. (Un esempio è l’innovativo sistema CRISPR/Cas9)
- Ablative, il fine di queste metodiche è interferire con l’espressione di un gene il cui prodotto proteico è alla base dello sviluppo del fenotipo patologico.
I ribozimi si collocano proprio nelle strategie ablative poiché agiscono per targettare e inattivare una molecola di mRNA, coinvolta nell’espressione proteica imputata alla malattia.
La scoperta
I ribozimi sono noti come “RNA catalitici” e sono infatti delle molecole di acido-ribonucleico, con la capacità di catalizzare essi stessi una reazione enzimatica. La tappa storica che ha condotto al loro odierno impiego, risale agli anni ’80 grazie al contributo di Thomas R. Cech e Sidney Altman (premi Nobel per la chimica nel 1989).
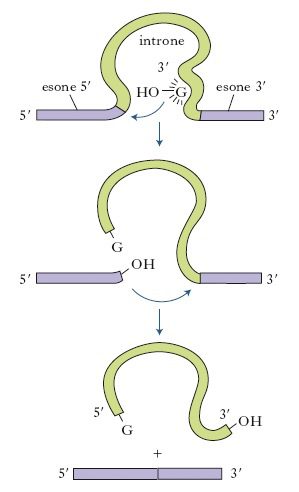
Alla base dell’identificazione dei ribozimi ci fu l’osservazione del meccanismo di splicing nel protozoo ciliato Tetrahymena thermophila. L’organismo era capace di autosplicing: l’introne di un trascritto di pre-mRNA era in grado, cioè, di promuovere la propria catalisi e di auto- rimuoversi dal filamento di acido nucleico. (Fig. 1)
La dimostrazione scientifica fu operata dai due studiosi mettendo in atto un test di splicing che dimostrò come l’introne in questione, fosse capace di escludersi autonomamente dal pre-mRNA anche in presenza di proteine nucleari che generalmente, agiscono come aiutanti del processo di maturazione del trascritto.
I ribozimi sono protagonisti di un’altra importantissima teoria: “ipotesi del mondo a RNA”. Secondo questa ricostruzione Walter Gilbert ha supposto che le forme di vita primordiali, usassero l’RNA sia come acido nucleico che come molecola catalitica ancora prima del DNA. Un’implicazione logica di quanto detto sarebbe che l’acido- ribonucleico, sia da considerarsi come la primitiva fonte di origine della vita.
Caratteristiche chimico-fisiche dei ribozimi
Il bersaglio molecolare dei ribozimi è quindi un mRNA e il loro compito, è quello di favorirne la degradazione mediante un taglio enzimatico. Poiché devono tagliare il target è fondamentale che abbiano una forma tridimensionale correttamente ripiegata nello spazio; questo favorisce l’identificazione di una tasca enzimatica che interagisce con il substrato in modo specifico. L’appaiamento tra le due molecole avviene con una complementarietà di pochi nucleotidi e perciò i singoli ribozimi, hanno la capacità di poter legare più acidi ribonucleici, con scarsa specificità. Le molecole in questione riconoscono una porzione di mRNA a livello del sito catalitico e agiscono eliminandone i legami fosfodiesterici senza l’aiuto di alcuna nucleasi.
Una delle pricnipali caratteristiche dei ribozimi è che possono tagliare in due conformazioni diverse:
- Conformazione in CIS, in questo modo sono in grado di tagliare sé stessi (self-splicing).
- Conformazione in TRANS, degradano la molecola bersaglio.
Molti di loro sono dei “metalloenzimi” e, perciò, richiedono la presenza di cationi metallici nel sito attivo per procedere alla degradazione. Gli ioni metallici, ad esempio Mg2+, hanno un ruolo di stabilizzazione in quanto operano schermando le cariche polianioniche dell’acido nucleico bersaglio.
Alcuni RNA catalitici sono costituiti solo da RNA con funzione enzimatica, altri invece risultano far parte di complessi ribonucleoproteici, come nel caso di “RNAse P” di E. coli. (Fig. 2)
Molti ribozimi naturali sono stati sottoposti a modifiche chimiche, di stabilizzazione e miglioramento del delivery, o ne sono stati creati di nuovi non naturali (ribozimi artificiali) per la loro applicazione in terapia genica.

Classificazione morfologica dei ribozimi
Al momento sono riconosciute sette classi di ribozimi naturali che si differenziano per meccanismo d’azione, grandezza e forma. Partendo dal più grande, e in ordine decrescente, si può stilare un elenco:
- rRNA 23s, componente della subunità 50s dei ribosomi procariotici ed è ad azione peptidil-trasferasica, promuove cioè la formazione dei legami peptidici tra amminoacidi.
- Introni di tipo I e di tipo II, operano auto-splicing e richiedono la presenza di ioni metallici.
- RNAse P, è un complesso ribonucleoproteico che processa il tRNA precursore.
- RNA satellite di Neurospora
- Ribozima del virus dell’epatite delta (HDV)
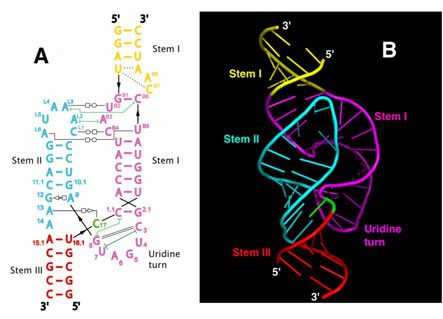
A completare la classificazione morfologica, all’interno del gruppo degli “small ribozyme”, sono i ribozimi Hammerhead (Fig. 3) e Hairpin, molto usati nelle strategie di terapia genica. Entrambi sono isolati a partire da viroidi e virusoidi delle piante, sono caratterizzati dalla presenza di domini stelo-ansa. In natura le due molecole citate sono in grado di operare esclusivamente dei tagli in conformazione cis ma, se sottoposti a modifiche che li rendono adatti per l’applicazione clinica, possono degradare un mRNA bersaglio.
Generare dei ribozimi idonei a tagliare in conformazione trans, vuol dire modificarne la struttura in modo che il target riesca ad appaiarsi alla struttura dell’RNA catalitico, precisamente a livello del sito di taglio. Una particolarità degli Hammerhead consiste nel fatto che nella regione di catalisi, debba essere presente una sequenza nucleotidica conservata: NUH. Questo rende più specifico l’appaiamento limitando i possibili effetti off-target determinati dalla versatilità dei ribozimi.
Il metodo “Selex”
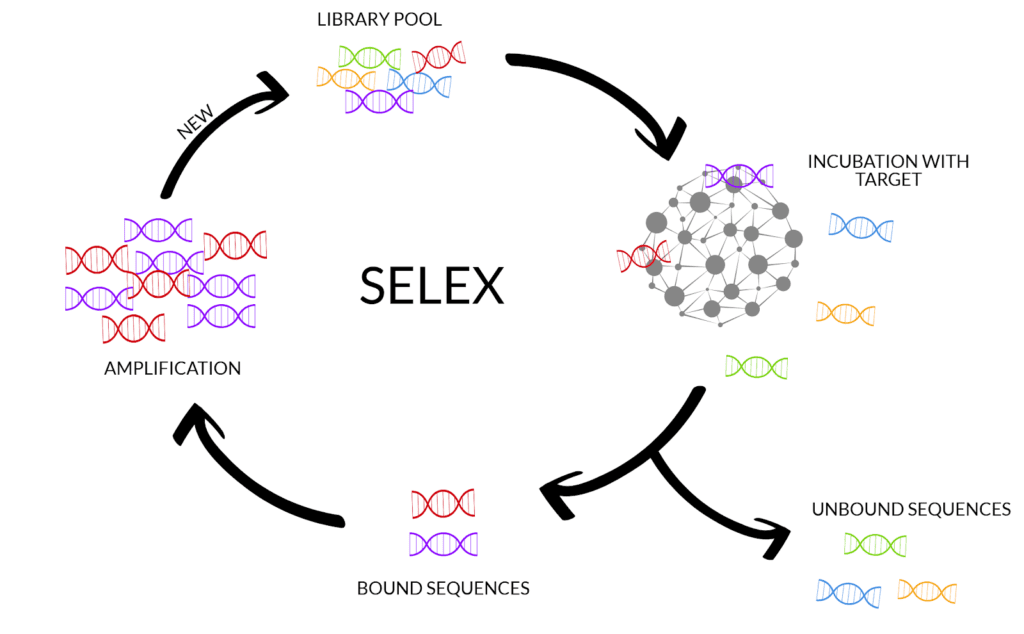
L’ottenimento di ribozimi artificiali è possibile grazie alla metodica selex. Il procedimento inerente alla tecnica citata prevede cicli ripetuti di trascrizioni in vitro e PCR, partendo da una library di sequenze random di RNA. (Fig. 4)
La presenza di frammenti casuali di acido- ribonucleico è essenziale per ottenere delle molecole che si ripiegheranno in modo fortuito, potendo interagire con specificità diversa al bersaglio. Procedere effettuando la metodica selex per ora resta un passaggio fondamentale perché, tutt’ora, è impossibile prevedere a priori, quale sequenza possono legare i ribozimi artificiali. Ultimamente si sta sviluppando il ramo della chimica computazionale che, mediante modelli 3D, risulta essere uno strumento per confrontare la struttura del bersaglio e dell’RNA catalitico, prevedendo un’interazione tra i due.
Nella selex partendo da frammenti di RNA, prima di procedere allo step di trascrizione, si deve operare una rt-PCR per ottenere intermedi a cDNA; alla fine del procedimento avviene poi una riconversione in RNA. La selezione dei ribozimi adatti all’applicazione contro uno specifico mRNA, avviene al termine di circa 6-20 cicli del metodo attraverso una separazione per cromatografia.
Applicazioni terapeutiche
I ribozimi attualmente sono usati per il trattamento di malattie autosomiche dominanti, patologie virali e in campo oncologico. La strategia utilizzata è per tutti la stessa ma i bersagli molecolari, sono diversi in base alla loro applicazione; nel caso dei virus ad esempio il target è rappresentato dagli mRNA deputati alla replicazione.
L’impiego più comune dei ribozimi riguarda due patologie molto diffuse nella popolazione:
- Retinite pigmentosa, causata da una mutazione a livello del gene della Rodopsina. L’idea è stata creare un RNA catalitico in grado di tagliare e degradare solo l’mRNA patologico ossia possedente la mutazione (sostituzione di una Prolina con Istidina in posizione 23).
- Ribozimi anti- HIV, in questo caso la strategia prevista è ex vivo. Dal paziente sono prelevate le staminali ematopoietiche in cui la sequenza codificante il ribozima terapeutico, è inserita mediante vettori virali. Alla fine della trasfezione, e dopo aver esteso la popolazione cellulare, le cellule sono inserite nuovamente nel paziente. Uno dei trial clinici attivati secondo questa metodica, prevede l’utilizzo di un Hammerhead (OZ1) rivolto contro la regione tat-vpr di HIV.
Quello che emerge chiaramente dalle considerazioni fatte è che la branca della terapia genica è in continua espansione e punta, all’ottenimento di terapie poco invasive e di massima riuscita.
Gaia Bruno
Fonti
- Mauro Giacca – Terapia Genica – Springer biomed
- https://www.sciencedirect.com/topics/medicine-and-dentistry/ribozyme
- https://moodle2.units.it/pluginfile.php/170904/mod_resource/content/1/Lezione%203.pdf