Caratteristiche
Phocanema azarasi (già conosciuto come Pseudoterranova azarasi) è un verme cilindrico e parassita i cui ospiti definitivi sono dei mammiferi pinnipedi: le foche (comuni e barbute, Phoca vitulina e Erignathus barbatus) e i leoni marini (di Steller e della California, Eumetopias jubatus e Zalophus californianus). Si tratta di un nematode della stessa famiglia di Anisakis, e per questo motivo, la malattia che esso provoca, è chiamata anisakidosi. La sua distribuzione geografica si estende dall’Oceano Pacifico nord-occidentale fino ai mari che circondano il Giappone. Il ciclo vitale di P. azarasi (Fig.1) coinvolge i mammiferi marini come ospiti definitivi, i crostacei come ospiti intermedi e i pesci che possono essere parassitati come ulteriori ospiti intermedi.
Ciclo vitale di Phocanema azarasi
Le uova non ancora embrionate vengono espulse con le feci dagli ospiti definitivi, nell’acqua le uova diventano embrionate e al loro interno le larve si sviluppano fino allo stadio L3. Queste larve sgusciano dalle uova, e sono già capaci di nuotare nell’acqua, e ingerite da crostacei, si sviluppano nelle loro cavità interne. Questi crostacei sono mangiati dai pesci. Qui le larve L3 abbandonano i visceri per trasferirsi nel mesentere e nel tessuto muscolare. Successivamente, attraverso l’ingestione di pesci infetti, le larve L3 possono risalire la catena alimentare, trasportate da ospiti accidentali. Gli ospiti accidentali sono quegli organismi in cui il parassita può sopravvivere, senza compiere alcun ulteriore sviluppo. Ad ogni modo, i pesci e gli eventuali ospiti accidentali costituiscono un alimento per i mammiferi marini, nei quali le larve terminano il loro sviluppo: attraverso due mute, esse raggiungono lo stadio L4, poi la forma adulta e successivamente si accoppiano.
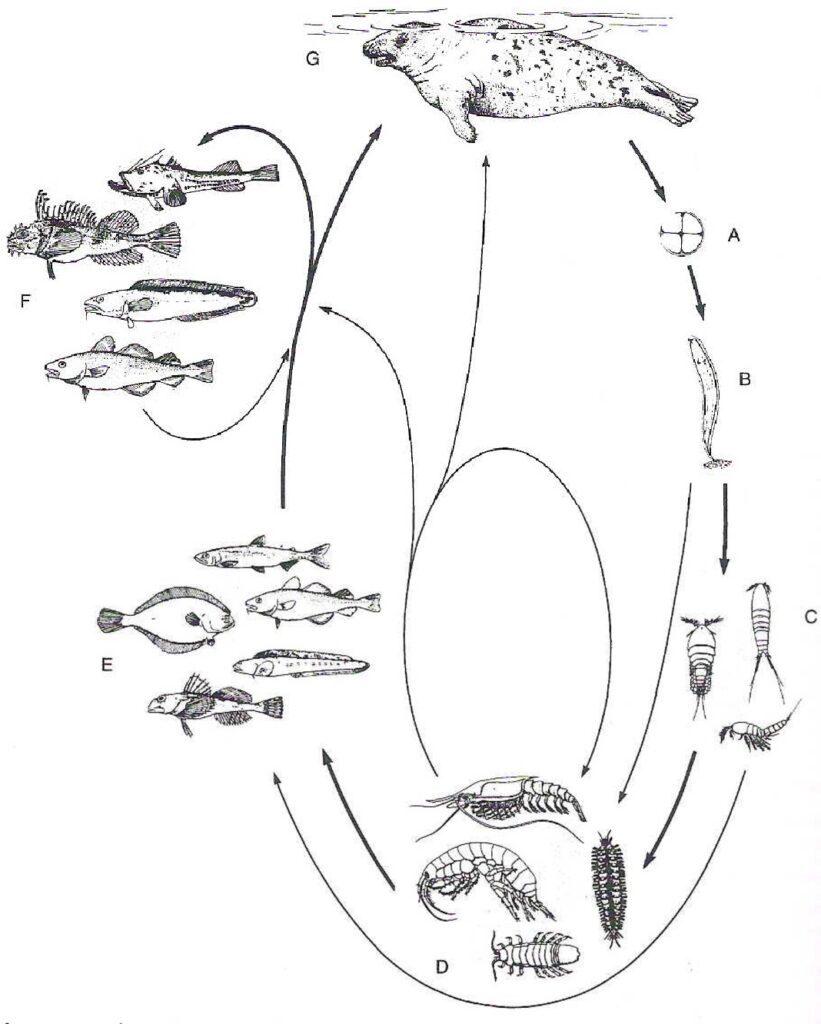
L’essere umano può essere un ospite accidentale, ma in questo caso il ciclo vitale del parassita si interrompe e le larve muoiono prima di poter raggiungere lo stadio adulto.
Filogenesi
| Dominio | Eukaryota |
| Regno | Animalia |
| Phylum | Nematoda |
| Classe | Chromadorea |
| Ordine | Rhabditida |
| Famiglia | Anisakidae |
| Genere | Phocanema |
| Specie | Phocanema azarasi |
Morfologia strutturale di Phocanema azarasi
P. azarasi ha una lunghezza compresa tra 2 e 7 cm, e il punto in cui c’è la massima larghezza è vicino alla metà del corpo. Il corpo del verme è ricoperto di una cuticola rossastra formata da una serie di numerosi anelli poco evidenti anche a forte ingrandimento. La bocca è situata all’estremità anteriore ed è formata da 3 labbra di dimensioni approssimativamente uguali, più larghe alla base e terminanti ognuna con una proiezione bilobata arrotondata munita di dentelli. Il labbro dorsale è munito di 2 doppie papille laterali, mentre le due labbra ventrali hanno ognuna una singola papilla laterale, una doppia papilla medio-laterale e un organo con funzione olfattoria chiamato anfide.
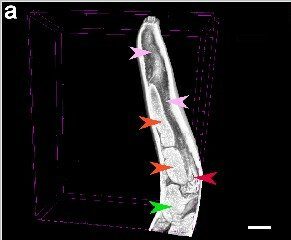
L’anello nervoso, che è il cervello del nematode, si trova a livello della prima metà dell’esofago. Le Deiridi (papille tattili) sono leggermente posteriori all’anello nervoso. L’esofago è relativamente lungo e leggermente più largo posteriormente che anteriormente (Fig. 3). Lo stomaco, chiamato ventricolo, è più stretto rispetto alla larghezza massima dell’esofago ed è più lungo che largo. Lo stomaco è seguito dall’intestino, in cui il cieco intestinale è corto e si estende anteriormente fino a superare di poco l’estremità anteriore del ventricolo. Il poro escretore si trova vicino alla bocca, in mezzo alle basi delle labbra ventrali.
Patogenesi
Le infezioni da P. azarasi possono influire negativamente sulla salute dei pesci selvatici, sulla loro abilità nel nuoto e di conseguenza anche sulla loro probabilità di sopravvivenza. Le larve L3 vengono ingerite dai pesci predatori quando si nutrono di altri pesci o crostacei infetti.
Patogenesi nei pesci
Nello stomaco di questi pesci predatori le larve si attivano e poi, attraversando la parete gastrica, si spostano verso la cavità peritoneale, verso i muscoli oppure verso altri organi come il fegato. Se la larva raggiunge il tessuto muscolare, le cellule dell’ospite la racchiudono in una capsula. I merluzzi e gli sperlani, colpiti da questo “tarlo del muscolo”, nuotano meno bene e di conseguenza muoiono più facilmente. Si ritiene che, mentre si sposta da un tessuto all’altro, la larva produca pentani e pentanoli che funzionano da anestetici, ostacolando così la contrazione muscolare. Le difficoltà nel nuoto, provocate dalla presenza del parassita, aumentano la probabilità che, come conseguenza, il pesce predatore venga a sua volta predato dai mammiferi marini.
Patogenesi nei Mammiferi pinnipedi
Nelle foche e nei leoni marini, le larve si stabiliscono nel fondo dello stomaco, dove vengono parzialmente incorporati nelle pareti e provocano lesioni. Una volta raggiunta la forma adulta, i vermi rimangono sempre incorporati nelle pareti dello stomaco, che si infiammano in maniera cronica.
Patogenesi nell’uomo
Si è dimostrato che P. azarasi può provocare nell’uomo malattie di gravità variabile, se vengono consumati pesci infetti crudi o poco cotti. Talvolta l’infezione è del tutto asintomatica, e il verme viene eliminato con le feci o attraverso il vomito. Seppur i casi di infezione da parte di questo parassita nell’uomo siano piuttosto rari, nell’epoca della globalizzazione tali eventi hanno suscitato un certo scalpore e reazioni di disgusto e indignazione.
- Nel 2009 in Giappone una donna tossendo sputò fuori una larva L4 di 35 mm.
- Nel 2017 una bambina giapponese di 5 anni aveva sviluppato un’ernia strozzata all’inguine. Una porzione di circa 5 cm era gonfia, molliccia e arrossata. L’area infiammata subì quindi un intervento chirurgico che asportò una capsula di tessuto contenente il parassita, il quale aveva raggiunto questa sede esterna all’intestino.
- Nel 2020, a Tokyo una giovane donna, che soffriva di tosse e mal di gola, scoprì di avere un verme di 38 mm (una larva L4) infilato nella gola dopo aver mangiato del sashimi, piatto tipico giapponese a base di pesce crudo.
A causa di alcuni allergeni rilasciati dalle larve nei muscoli dei pesci, i soggetti più sensibili, in seguito anche al solo contatto con i prodotti contaminati, possono manifestare reazioni allergiche, con orticaria, gonfiori cutanei, formicolio e capogiri.
Metodi di identificazione di Phocanema azarasi
I metodi di identificazione sono svariati e dipendono sia dal materiale esaminato, sia dallo scopo per cui si esamina il materiale. Nel caso dell’industria alimentare, durante la lavorazione del pesce, si ricorre ad un esame visivo, che può essere supportato da una tecnica chiamata speratura (Fig. 4). Si appoggiano i filetti di pesce su una tavola luminosa e si sfrutta lo spessore limitato e la trasparenza dei filetti, per poter osservare all’interno della muscolatura del pesce la presenza di corpi opachi alla luce, riconoscibili come vermi spesso raggomitolati. Nei casi di infestazioni visibili e diffuse, il prodotto sarà quindi escluso dal consumo umano.

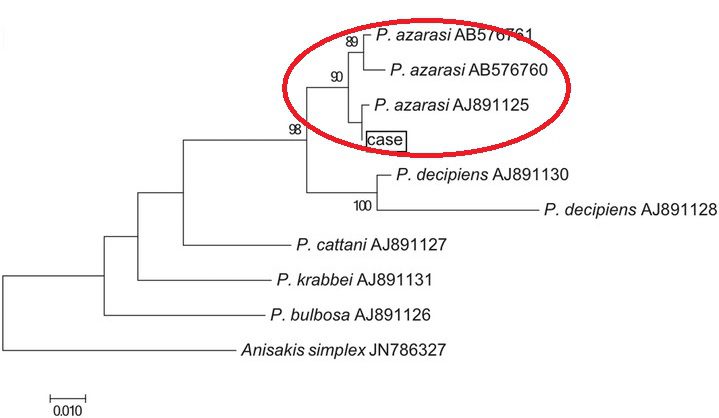
I criteri morfologici permettono di attribuire alla famiglia Anisakidae le larve reperite negli alimenti o estratte dai pazienti o da altri animali infetti. Infatti P. azarasi è fisicamente indistinguibile da P. decipiens, P. krabbei, P. bulbosa e P. cattani. Quindi, se abbiamo a disposizione un filetto di pesce, si procede a una digestione cloropeptica. Successivamente, per poter riconoscere con precisione il verme è necessaria una metodica biomolecolare basata sulla reazione a catena della polimerasi (PCR), che indichi la presenza di sequenze di DNA specifiche della sola specie P. azarasi.
Terapia
In Giappone, la maggior parte dei pazienti infetti, manifesta dolori addominali, e le larve sono quindi rimosse dallo stomaco mediante endoscopia (Fig. 5). In questa metodica si utilizza un piccolo tubo flessibile contenente fibre ottiche, che viene inserito attraverso la bocca, e permette di visualizzare l’interno dello stomaco attraverso una microcamera posta alla sua estremità. Questo tubo è inoltre dotato di una piccola pinza meccanica che serve a rimuovere il verme. Il paziente coricato su un fianco, prima di sottoporsi all’endoscopia, assume un sedativo sotto forma di spay per la gola, il quale riduce il disagio provocato dal tubo. La presenza dello strumento non ostacola la respirazione. L’intervento dura dai 15 ai 30 minuti, dopo i quali si rimuove lentamente il tubo.

Per l’eliminazione del parassita, il trattamento farmacologico a base di albendazolo può essere consigliato nei casi di anisakidosi, ma non è sempre efficace e spetta al medico la decisione di doverlo prescrivere. Lo stesso discorso vale per la cura delle eventuali reazioni allergiche.
Metodi di prevenzione e controllo
Per prevenire le infezioni dovute all’ingestione di vermi parassiti dei pesci, è fondamentale agire attraverso:
- l’educazione alimentare: per informare i consumatori sul rischio legato alla trasmissione dei parassiti dei pesci.
- il controllo ispettivo, secondo il Pacchetto Igiene della Normativa Europea
In base a questa normativa sono indicati diverse preparazioni che hanno lo scopo di uccidere i parassiti:
- Alte temperature: 60°C per 1 minuto;
- Congelamento: -20°C per almeno 24 ore (o a -35°C per 15 ore);
- Affumicatura: a 60°C si uccidono tutte le larve;
- Marinatura: si ottiene una conserva di pesce sotto sale e aceto
- Salagione
La Commissione Europea ha consultato l’Agenzia Europea per la Sicurezza Alimentare (EFSA), al fine di individuare un trattamento per l’uccisione dei parassiti nei prodotti ittici che sono a rischio. Pertanto, la normativa obbliga gli operatori del settore alimentare a congelare i propri prodotti finiti a una temperatura non superiore ai -20°C per almeno 24 ore, prima di poterli commercializzare.
Fonti
- Paggi L, Mattiucci S, Gibson DI, Berland B, Nascetti G, Cianchi R et al. Pseudoterranova decipiens species A and B (Nematoda, Ascaridoidea): nomenclatural designation, morphological diagnostic characters and genetic markers. Syst Parasitol. 2000 Mar;45(3):185-97.
- Zhu XQ, D’Amelio S, Palm HW, Paggi L, George-Nascimento M, Gasser RB. SSCP-based identification of members within the Pseudoterranova decipiens complex (Nematoda: Ascaridoidea: Anisakidae) using genetic markers in the internal transcribed spacers of ribosomal DNA. Parasitology. 2002 Jun;124(Pt 6):615-23.
- Regolamento (CE) n. 853/2004 del Parlamento europeo e del Consiglio, del 29 aprile 2004, che stabilisce norme specifiche in materia di igiene per gli alimenti di origine animale
- Arizono N, Miura T, Yamada M, Tegoshi T, Onishi K. Human infection with Pseudoterranova azarasi roundworm. Emerg Infect Dis. 2011 Mar;17(3):555-6.
- Marigo J, Taniwaki SA, Pinto PL, Soares RM, Catão-Dias JL. MOLECULAR IDENTIFICATION OF Pseudoterranova azarasi LARVAE IN COD (Gadus sp.) SOLD FOR HUMAN CONSUMPTION IN BRAZIL. Rev Inst Med Trop Sao Paulo. 2015 Dec;57(6):537-9.
- Mitsuboshi A, Yamaguchi H, Ito Y, Mizuno T, Tokoro M, Kasai M. Extra-gastrointestinal anisakidosis caused by Pseudoterranova azarasi manifesting as strangulated inguinal hernia. Parasitol Int. 2017 Dec;66(6):810-2.
- Mladineo I, Hrabar J, Smodlaka H, Palmer L, Sakamaki K, Keklikoglou K et al. Functional Ultrastructure of the Excretory Gland Cell in Zoonotic Anisakids (Anisakidae, Nematoda). Cells. 2019 Nov 17;8(11):1451.
- Fukui S, Matsuo T, Mori N. Palatine Tonsillar Infection by Pseudoterranova azarasi. Am J Trop Med Hyg. 2020 Jul;103(1):8.
- Bao M, Giulietti L, Levsen A, Karlsbakk E. Resurrection of genus Phocanema Myers, 1959, as a genus independent from Pseudoterranova Mozgovoĭ, 1953, for nematode species (Anisakidae) parasitic in pinnipeds and cetaceans, respectively. Parasitol Int. 2023 Dec;97:102794.
Crediti immagini
- Immagine in evidenza: https://nypost.com/wp-content/uploads/sites/2/2020/07/worm-81.jpg?quality=75&strip=all
- Figura 1: https://www.semanticscholar.org/paper/Sealworms-(Pseudoterranova-decipiens)-in-shorthorn-L%C3%A4hdekorpi/42455cc5f6c91372341cbd1bde6d2b82e37a7ec8/figure/0
- Figura 2: https://www.ajtmh.org/view/journals/tpmd/103/1/full-tpmd200175f1.jpg
- Figura 3: https://www.researchgate.net/profile/Ivona-Mladineo/publication/337315701/figure/fig4/AS:826220048576512@1573997618124/Representative-longitudinal-2D-a-b-and-transversal-3D-c-f-renderings-of-the-adult.jpg
- Figura 4: https://carsoe.com/media/5mjh0hau/candling-tables-4.jpg?anchor=center&mode=crop&width=800&height=600&rnd=132582239626730000&format=webp
- Figura 5: https://www.gastroenterologopalermo.it/images/gastroscopia.png