Caratteristiche
Clonorchis sinensis (conosciuto anche come Opistorchis sinensis, verme epatico cinese e verme epatico orientale) (Fig. 1) è un verme parassita appartenente al phylum dei Platelminti (cioè vermi piatti, in contrapposizione ai nematodi o vermi cilindrici) e alla sottoclasse dei Digenei, il cui nome indica lo svolgimento di due tipologie di riproduzione, sessuata e asessuata. Come altri vermi piatti dello stesso ordine, C. sinensis possiede due ventose che fungono da organi di adesione, è ermafrodita, ossia dotato degli apparati riproduttori maschile e femminile, è sprovvisto dei sistemi respiratorio e circolatorio, e presenta dei sistemi nervoso, escretore e digerente primitivi. Inoltre, assorbe i carboidrati e gli amminoacidi mediante pinocitosi grazie ai microvilli che ricoprono il tegumento.

C. sinensis è diffuso prevalentemente in vari paesi dell’Asia orientale, tra cui Cina (dove avviene l’85% di casi di infezione), Thailandia, Vietnam, Corea, Taiwan, Giappone e regioni più orientali della Russia (Fig. 2), e risiede negli ambienti acquatici, dove compie il proprio ciclo vitale. Non è un parassita esclusivamente umano, bensì tra suoi organismi ospiti rientrano anche canidi, felidi, maiali, mustelidi e roditori, e raffigura l’agente eziologico della malattia chiamata opistorchiasi o clonorchiasi, che colpisce il fegato.

La scoperta di questo platelminta risale al 1874 grazie a un professore di patologia del Medical College Hospital di Calcutta, James McConnell, il quale scovò il parassita in un falegname cinese di 20 anni che morì l’8 settembre di quell’anno. L’esame autoptico rivelò un rigonfiamento del fegato, i cui dotti biliari erano dilatati e otturati da “piccoli e scuri corpi vermiformi”. McConnell li estrasse, li comparò con altri due vermi, ovvero Fasciola hepatica e Distoma lanceolatum, e notò delle differenze significative. Il 21 agosto 1875 pubblicò le sue valutazioni sulla rivista medica The Lancet. Nel medesimo anno lo scienziato inglese Thomas Spencer Cobbold proclamò la prima descrizione scientifica del verme e lo nominò Distoma sinense, appellativo che, nel 1876, fu modificato in Distomum spithulatum dal zoologo tedesco Rudolf Leuckart.
Tra il 1877 e il 1883, in Cina e in Giappone, si verificarono altri casi di infezione da questo platelminta, e nel 1895 il zoologo ed entomologo francese Charles Émile Blanchard introdusse un nuovo genere, Opistorchis (dal greco “opisthen”, che significa “dietro”, e “orchis”, che vuol dire “testicolo”); date le somiglianze con altri membri, la specie sinense si spostò in questo nuovo genere. Il zoologo e parassitologo tedesco Arthur Looss effettuò delle ulteriori analisi e illustrò delle diversità nelle caratteristiche generali di Opistorchis, soprattutto nei testicoli altamente ramificati; per tale ragione nel 1907 creò il genere Clonorchis, dal greco “klon”, ramo/ramoscello, e “orchis”, testicolo.
Filogenesi
| Dominio | Eukaryota |
| Regno | Animalia |
| Sottoregno | Eumetazoa |
| Superphylum | Protostomia |
| Phylum | Platyhelminthes |
| Classe | Trematoda |
| Sottoclasse | Digenea |
| Ordine | Opistorchiida |
| Famiglia | Opistorchiidae |
| Genere | Clonorchis |
| Specie | C. sinensis |
Morfologia
Il verme adulto (Fig. 3) di C. sinensis è caratterizzato da un corpo appiattito a livello sia dorsale che ventrale, leggermente allungato e snello, e una forma lanceolata, cioè somigliante a una foglia, affusolata all’estremità anteriore e arrotondata a quella posteriore; le dimensioni sono 15-20 mm di lunghezza e 3-4 mm di larghezza. Sulla regione anteriore si colloca l’apertura orale, che è circondata da una ventosa, mentre sulla porzione dorsale si trova l’altra ventosa, che è collegata all’apparato riproduttore. L’intestino è biforcato e a fondo cieco. Per quanta riguarda gli organi genitali, il platelminta possiede un ovaio sferoidale situato al centro del corpo e due testicoli assai diramati posti al margine posteriore; l’utero e i dotti spermatici si aprono sul poro genitale (o gonopore). Su entrambi i lati del corpo sono distribuite delle ghiandole notevolmente ramificate, chiamate ghiandole vitelline o vitellaria.

Le uova sono ovoidali, lunghe 26-30 μm, circondate da un guscio giallastro-marrone e dotate di opercolo (organo mobile che tappa il passaggio che permette l’uscita dell’embrione) all’estremità anteriore, mentre sul lato posteriore è possibile apprezzare un piccolo bozzo o una piccola spina curva.

Ciclo vitale e patogenesi
È importante sottolineare che C. sinensis è un parassita eteroxeno, ovvero raggiunge la maturazione passando per tre organismi ospiti diversi (Fig. 5). Il verme adulto rilascia le uova embrionate (contenenti l’embrione) all’interno dell’ospite definitivo, il quale le espelle con le feci. Nel momento in cui le uova vengono ingerite dal primo ospite intermedio (un mollusco gasteropode, soprattutto quelli del genere Parafossarulus) (Fig. 6), liberano una larva ciliata, il miracidio. Quest’ultimo va incontro a riproduzione asessuata e attraversa tre fasi, cioè sporociste, redia e cercaria. Il mollusco rilascia le cercarie, le quali hanno l’aspetto di vermi adulti dotati di una coda biforcuta che aiuta la locomozione; dopo un breve periodo di vita libera in acqua, le cercarie penetrano nei pesci di acqua dolce (salmonidi, ciprinidi), dove si incistano nella muscolatura e diventano metacercarie. Queste ultime presentano una forma rotondeggiante, sono circondate da una spessa parete cistica e al loro interno si può osservare il verme in fase di maturazione. A questo punto, se un essere umano, un gatto o un cane ingerisce il pesce infetto crudo o poco cotto, il processo di digestione favorisce la liberazione delle metacercarie dalla parete cistica; in seguito all’escistazione, che avviene nel duodeno, le larve si muovono controcorrente e, attraverso l’ampolla di Vater, si spingono fino alle vie biliari. Qui, nel giro di circa tre mesi, si sviluppano in vermi adulti (Fig. 7), e depongono le uova (fino a 4000 al giorno), che vengono espulse con le feci permettendo la ripetizione del ciclo. I parassiti si nutrono dell’epitelio biliare, procurando danni, e possono vivere nell’ospite definitivo per un periodi di 10-12 anni.


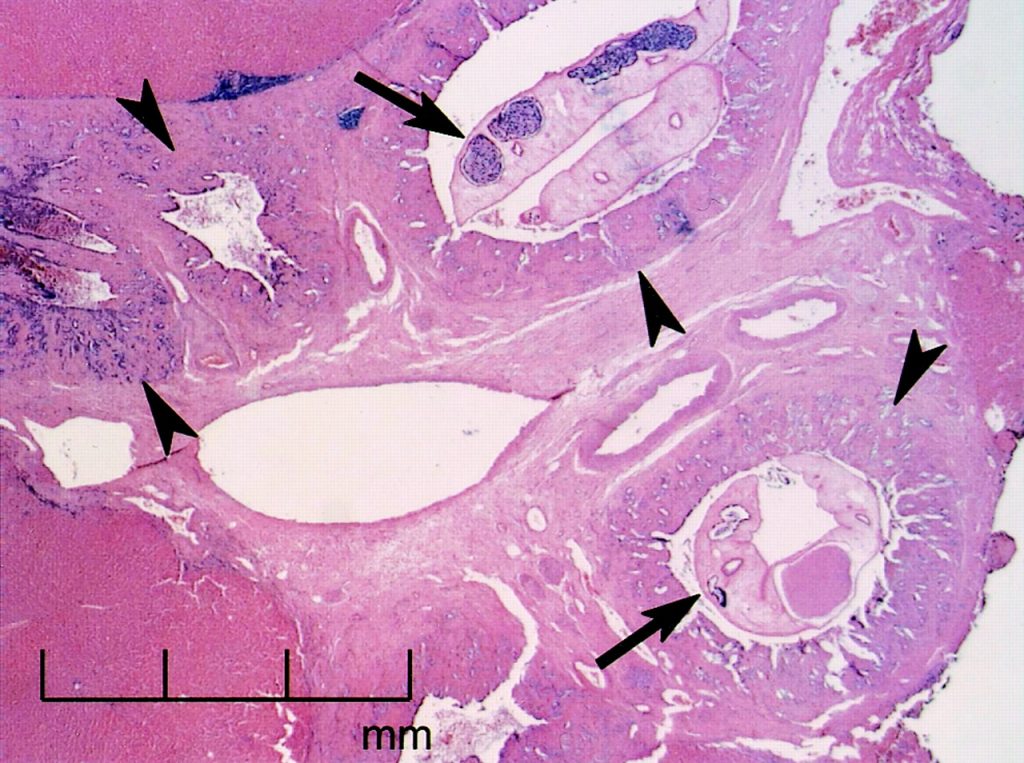
Negli esseri umani l’opistorchiasi di solito decorre in maniera asintomatica o con sintomi aspecifici come dolore addominale, diarrea e nausea. Tuttavia, la presenza di un numero cospicuo di parassiti può provocare il blocco del flusso biliare, con conseguente colestasi, ittero ostruttivo e malassorbimento di alcuni nutrienti (lipidi, vitamine liposolubili, ferro); la mancata assimilazione dei nutrienti comporta calo ponderale, anemia, fiacchezza, diarrea cronica e steatorrea (grassi nelle feci). In aggiunta a ciò, l’infezione cronica può condurre a colangite (infiammazione delle vie biliari), fibrosi e iperplasia (aumento del numero di cellule), fino ad arrivare alla cirrosi epatica, al colangiocarcinoma (tumore maligno che colpisce i dotti biliari) e all’epatocarcinoma. Proprio a causa della sua capacità di indurre la formazione di tumori, nel 2009 l’International Agency of Research on Cancer ha classificato O. sinensis come primo gruppo biologico cancerogeno.
Uno sguardo alla genesi del colangiocarcinoma (CCA)
I vermi adulti di C. sinensis determinano la modificazione tumorale dei colangiociti attraverso tre principali meccanismi interconnessi tra loro (Fig. 8):
- Danneggiamento tissutale dei dotti biliari causato dai parassiti che si nutrono dell’epitelio; mano mano che i vermi maturano, le lesioni si ingrossano e si ulcerano, comportando la liberazione di molecole dette DAMPs (pattern molecolari associati al danno). I continui danni meccanici comportano una perenne attivazione dei sistemi di riparazione, e quindi una prolungata infiammazione che può alterare lo stato cellulare;
- La presenza degli antigeni del parassita nell’epitelio dei dotti biliari innesca la risposta cellulare e l’infiammazione a livello dei dotti biliari infetti e l’infiltrazione delle cellule infiammatorie nei siti periduttali. In questo processo vengono coinvolti degli specifici recettori, ovvero i recettori di tipo Toll (TLRs), che riconoscono le molecole chiamate PAMPs (pattern molecolari associati ai patogeni) e i DAMPs, e mediano le risposte iniziali dell’immunità innata. L’interazione tra PAMPs/DAMPs e TLRs stimola l’attivazione di vie di segnalazione che conducono alla sintesi di citochine pro-infiammatorie come l’interleuchina 6 (IL-6). In aggiunta a ciò, l’infiammazione induce la produzione di intermedi reattivi dell’ossigeno e ossido nitrico, responsabili del danno al DNA delle cellule epiteliali;
- I parassiti secernono una serie di fattori mitogeni (stimolanti la divisione cellulare) che agiscono sui colangiociti contribuendo alla trasformazione neoplastica. Uno di questi fattori è Ov-GRN-1, una proteina avente una similarità di sequenza con un fattore di crescita presente nei mammiferi, la granulina (GNR). Tale proteina è overespressa in molti tumori umani (ovarico, mammario, epatico), promuove l’angiogenesi (formazione di nuovi vasi sanguigni), sopprime l’apoptosi (morte cellulare programmata) e contribuisce all’invasione tumorale. L’espressione della progranulina (il precursore di GNR) indotta dall’IL-6 genera una crescita aumentata del colangiocarcinoma. Inoltre, secondo una studio del 2003, pubblicato su Clinical Cancer Research, il blocco di GNR in una gamma di tipi di tumore riduce o inibisce interamente la progressione neoplastica. Detto questo, è pertinente che la molecola secreta da C. sinensis cooperi alla crescita neoplastica e riduca l’apoptosi.

Metodi di identificazione
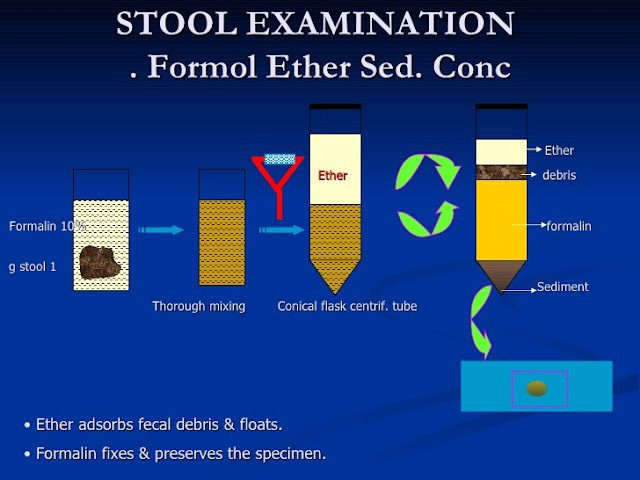
Una possibile infezione da C. sinensis dovrebbe essere sospettata quando un individuo lamenta sintomi al livello epatico e biliare, e ha mangiato pesci d’acqua dolci crudi o poco cotti in una regione endemica. Normalmente la diagnosi di opistorchiasi si basa sull’analisi microscopica delle feci, al fine di avvistare le uova del parassita. SI può effettuare l’osservazione diretta delle feci, oppure ricorrere alla tecnica della concentrazione del campione in etilacetato e formalina (Fig. 9); tra le due, la seconda è più affidabile, in quanto consente di concentrare maggiormente le uova eventualmente presenti.
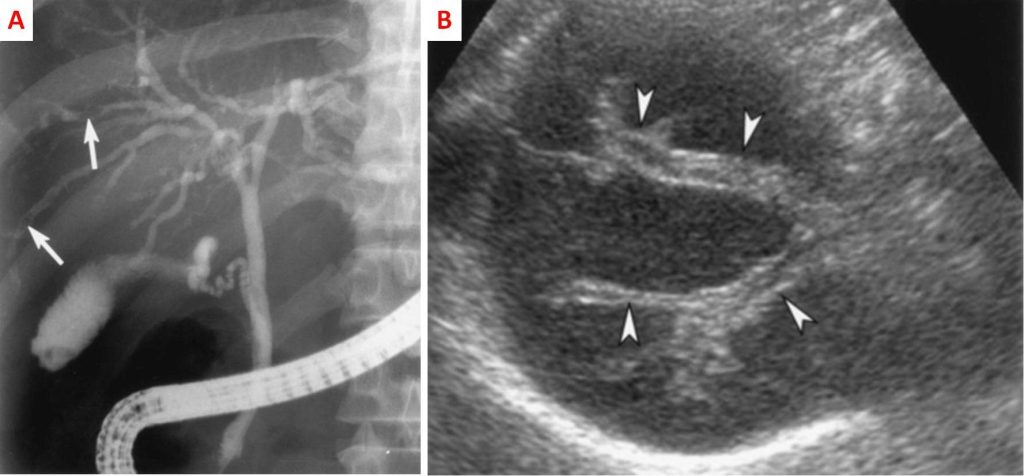
Spesso capita che l’opistorchiasi venga diagnosticata accidentalmente durante gli screening radiologici, in particolare mediante ultrasonografia dell’addome per scopi differenti, dato che i sintomi dell’infezione sono aspecifici. Le caratteristiche radiologiche comprendono dilatazione uniforme e diffusa dei dotti biliari intraepatici periferici (correlata con la presenza dei vermi), con o senza una leggera dilatazione dei dotti extraepatici (Fig. 10A). Tra l’altro, si possono scorgere delle anomalie dei dotti in cui la normale opacizzazione del lume è alterata; tali irregolarità hanno dimensioni di vari millimetri di diametro, compatibili con la larghezza del verme (Fig. 10B).
Terapia e profilassi
Per il trattamento dell’opistorchiasi, i farmaci di scelta sono il praziquantel o l’albendazolo; il primo agisce provocando la paralisi muscolari e alterando la morfologia del parassita, mentre il secondo blocca l’assemblaggio della tubulina, e quindi la divisione cellulare, e interferisce sulla captazione del glucosio.
Al fine di prevenire l’infezione, le strategie da adottare sono principalmente queste: cucinare appieno i pesci d’acqua dolce prima di mangiarli o, se si vogliono mangiare crudi, congelarli -20° C per almeno sette giorni oppure a -35° C per 15 ore.
Fonti
- http://mt-lectures.blogspot.com/2016/07/lecture-8-liver-flukes.html
- https://www.ncbi.nlm.nih.gov/books/NBK304354/
- https://www.cdc.gov/dpdx/clonorchiasis/index.html
- Cancrini G. 2003. “Parassitologia e tecniche di laboratorio”, Lombardo Editore
- Qian Men-Bao, Utzinger Jürg, Keiser Jennifer and Zhou Xiao-Nong. 2016. “Clonorchiasis”, The Lancet
- Yoshida Yukio. 2012. “Clonorchiasis—A historical review of contributions of Japanese parasitologists”, Parasitology International
- Sripa Banchob, Tesana Smarn, Yurlova Natalia and Nawa Yukifumi. 2017. “A historical review of small liver fluke infections in humans”, Parasitology International
- Jin-Joo Lee, Bong-Kwang Jung, Hyemi Lim, Mi Youn Lee, Sung-Yil Choi, Eun-Hee Shin and Jong-Yil Chai. 2012. “Comparative Morphology of Minute Intestinal Fluke Eggs That Can Occur in Human Stools in the Republic of Korea”, Korean J Parasitol
- Byung Ihn Choi, Joon Koo Han, Sung Tae Hong and Kyoung Ho Lee. 2004. “Clonorchiasis and Cholangiocarcinoma: Etiologic Relationship and Imaging Diagnosis”, Clinical Microbiology Reviews
- Hong ST and Fang Y. 2012. “Clonorchis sinensis and clonorchiasis, an update”, Parasitology International
- Sripa B, Brindley PJ, Mulvenna J, Laha T, Smout MJ, Mairiang E, Bethony JM and Loukas A. 2012. “The tumorigenic liver fluke Opisthorchis viverrini–multiple pathways to cancer”, Trends in Parasitology
- American Cancer Societ. 2013. “Known and Probable Human Carcinogens”
- Monica Brown Jones, Chad M. Michener, James O. Blanchette, Vladimir A. Kuznetsov, Mark Raffeld, Ginette Serrero, Michael R. Emmert-Buck, Emanuel F. Petricoin, David B. Krizman, Lance A. Liotta and Elise C. Kohn. 2003. “The granulin-epithelin precursor/PC-cell-derived growth factor is a growth factor for epithelial ovarian cancer”, Clinical Cancer Research
- https://mcdinternational.org/trainings/malaria/english/dpdx5/html/ImageLibrary/A-F/Clonorchiasis/body_Clonorchiasis_il3
- https://mltexpo.blogspot.com/2018/04/formal-ether-sedimentation-stool.html
Immagine in evidenza
- https://www.ansa.it/canale_terraegusto/notizie/dal_mare/2020/04/16/mercati-del-pesce-in-ripresa-sale-la-domanda-del-salmone_ed881e0c-6581-471b-920c-cf1b8b4a3ddf.html
- https://funghimedicinali.wmwp.it/epatopatia-malattie-del-fegato/