Caratteristiche
Il batterio Leclercia adecarboxylata è un bacillo Gram-negativo (Fig. 1) appartenente alla famiglia delle Enterobacteriaceae ed è l’unica specie inclusa nel genere Leclercia. È dotato di flagelli peritrichi, aerobio anaerobio facoltativo, catalasi positivo, ossidasi negativo, idrolizza l’esculina (un glucoside presente nella corteccia dell’ippocastano) e produce indolo (sottoprodotto della digestione dell’amminoacido triptofano). In aggiunta a ciò, sintetizza gas e acidi dalla fermentazione di diversi zuccheri come glucosio, lattosio, mannitolo, maltosio, arabinosio, mannosio e galattosio.

L. adecarboxylata raffigura un commensale della flora intestinale di alcuni animali compreso l’essere umano, presenta una distribuzione ubiquitaria in natura e si trova nell’acqua, nel suolo, negli alimenti, nei gusci d’uovo, nel latte, nei serbatoi di oli e grassi industriali e in molteplici ambienti naturali. È sensibile a un cospicuo numero di antibiotici, anche se da qualche anno sono stati documentati dei ceppi resistenti che esprimono enzimi come beta-lattamasi e metallo-beta-lattamasi. Questi conferiscono la tolleranza verso antibiotici beta-lattamici come la penicillina.
Malgrado negli esseri umani le patologie dovute a questo microorganismo siano inusuali, esso viene descritto come un patogeno umano emergente in grado di provocare infezioni negli individui immunodepressi come quelli affetti da tumori, leucemie, insufficienza renale e cirrosi epatica.
La prima descrizione di questo batterio risale al 1962 grazie al microbiologo francese H. Leclerc, il quale lo battezzò Escherichia adecaerboxylata. Tuttavia, saggi biochimici estesi, metodiche di ibridazione del DNA e studi di identificazione basati sull’informatica indussero a modificare la tassonomia.
Filogenesi
| Dominio | Prokaryota |
| Regno | Bacteria |
| Phylum | Proteobacteria |
| Classe | Gammaproteobacteria |
| Ordine | Enterobacteriales |
| Famiglia | Enterobacteriaceae |
| Genere | Leclercia |
| Specie | L. adecarboxylata |
Morfologia delle colonie
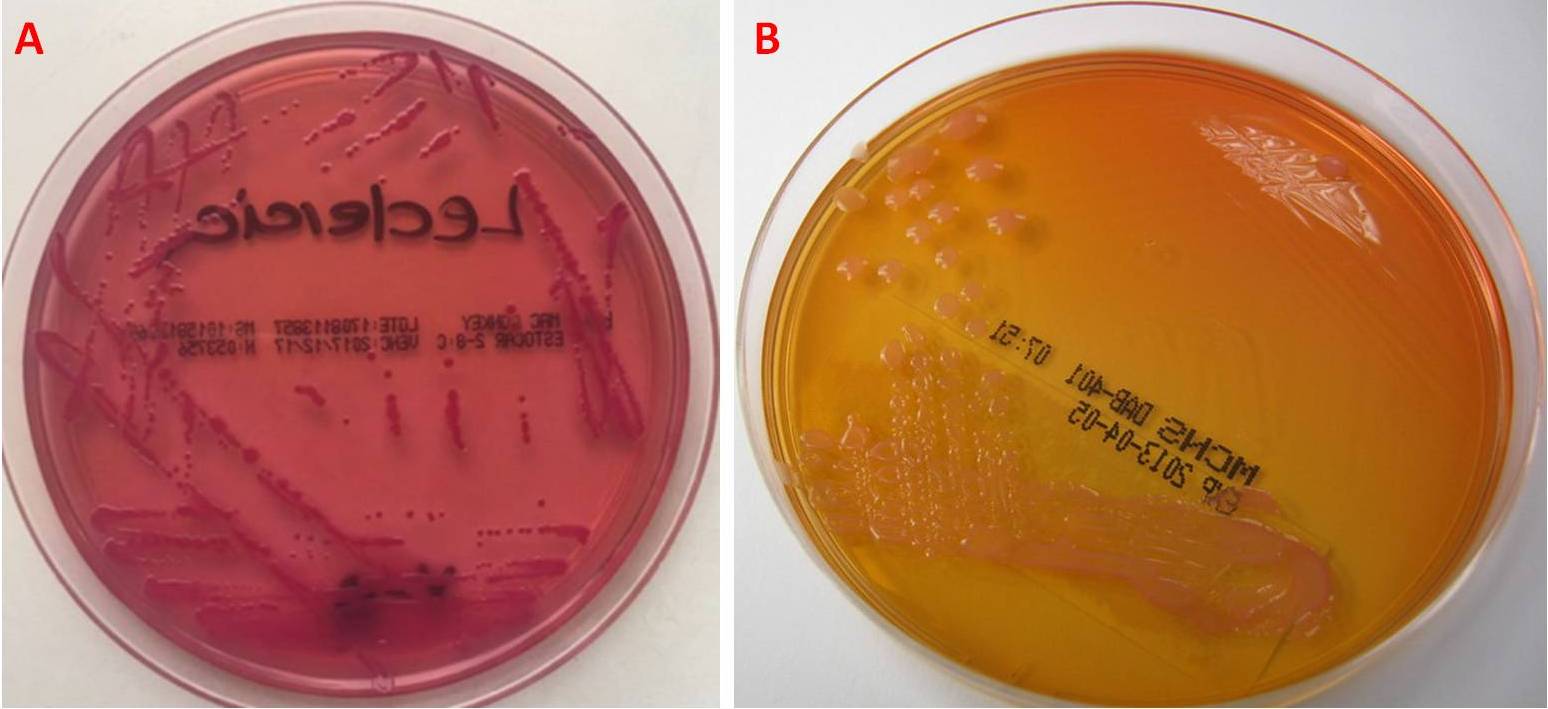
L. adecarboxylata si coltiva specialmente su agar sangue e agar MacConkey; sul primo le colonie appaiono bianco-grigiastre, lisce e prive di emolisi (gamma-emolitico) (Fig. 2), mentre sul secondo sono contraddistinte da un colore rosa acceso dovuto alla fermentazione del lattosio (Fig. 3A). Alcuni ceppi sintetizzano un pigmento giallo che comporta il viraggio del terreno e delle colonie al giallastro (Fig. 3B).

Patogenesi
L. adecarboxylata rappresenta un agente patogeno raro nella popolazione umana, sovente l’infezione avviene in seguito all’ingresso nelle ferite o attraverso il contatto con gli ambienti acquatici. È stata documentata una consistente quantità di casi di patologie negli adulti, mentre nei bambini la cifra di episodi è bassa.
Come avevamo accennato all’inizio, questo microorganismo si comporta come un patogeno opportunista negli individui aventi un sistema immunitario compromesso (da essi è stato isolato come coltura pura), tuttavia è in grado di causare patologie anche nelle persone immunocompetenti (da queste il batterio è stato identificato all’interno di colture polimicrobiche).
Descriviamo qui alcuni eventi di infezione da L. adecarboxylata:
- Un ragazzo di 11 anni si ferì al piede con una scheggia di legno cadendo dalla bicicletta; ciò provocò la formazione di un edema (senza liberazione di liquido) che rimase fino al giorno seguente anche dopo la pulizia della ferita con acqua. Il giovane quindi si recò al pronto soccorso dove gli fu somministrata cefalexina orale allo scopo di prevenire la cellulite. La terapia antibiotica non ebbe l’esito atteso, il gonfiore peggiorò e rilasciò del liquido purulento giallastro; a questo punto il bambino fu ricoverato e i medici eseguirono una radiografia del piede, che evidenziò un edema focale dei tessuti molli a livello del dorso ma nessun corpo estraneo (Fig. 4). Il paziente iniziò una terapia intravenosa con clindamicina. L’analisi di un campione di pus condusse all’identificazione di L. adecarboxylata, che si rivelò resistente all’ampicillina ma sensibile a cefazolina, gentamicina e tobramicina. Considerando che il ragazzo rispondeva bene alla terapia con clindamicina, i medici decisero di continuare il trattamento con un eventuale passaggio dalla somministrazione intravenosa a quella orale. Tuttavia, dopo due settimane dalla dimissione, ci fu un’altra fuoriuscita di liquido dalla ferita. L’esame ecografico mise in evidenza una struttura che si sospettava fosse un corpo estraneo o tessuto di granulazione. A causa della natura persistente della lesione, il paziente fu sottoposto a una visita ortopedica per l’esplorazione e lo sbrigliamento della ferita; nel tessuto di granulazione rimosso non venne trovato alcun corpo estraneo e la coltura intraoperatoria risultò negativa per microorganismi. Il ragazzino fu dimesso, fece una terapia orale con cefalexina e non ebbe ulteriori complicazioni;

- Un ragazzo di 16 anni (avente una storia di nefropatia da reflusso di grado alto, rene sinistro solitario e incontinenza urinaria) era affetto da malattia renale cronica al quarto stadio, con livelli di creatinina sierica di 6,1 mg/dl, che comportò l’applicazione del tubo di nefrostomia percutanea per un periodo di cinque mesi. Quattro giorni dopo la rimozione del tubo, il paziente giunse al pronto soccorso con nausea e vomito; non aveva febbre o dolore al fianco sinistro, non aveva subito alcun trauma e non era entrato in contatto con acqua contaminata. La zona della nefrostomia non era infetta, i valori di creatinina e urea nel sangue erano rispettivamente 5.0 mg/dl e 55 mg/dl e all’ecografia non risultò alcun cambiamento del rene che potesse suggerire la pielonefrite. Comunque, l’urinocoltura mostrò la crescita 70000 cfu/ml di L. adecarboxylata, che era sensibile a vari antibiotici come ampicillina, cefazolina, gentamicina, tobramicina e nitrofurantoina. L’adolescente venne dimesso dall’ospedale e i medici gli prescrissero un trattamento con cefalexina orale. Una settimana dopo tornò al pronto soccorso accusando dolore al fianco sinistro e vomito intermittente, ma nessuna linea di febbre. Considerata la sua situazione sociale complicata, non aveva rispettato la compliance della terapia antibiotica, così fu sottoposto a terapia intravenosa con ceftriaxone. Ciò portò al miglioramento dei valori della creatinina (4,3 mg/dl), anche se l’urea rimase elevata (53 mg/dl) e l’albumina si abbassò a 3,5 g/dl. L’analisi delle urine si dimostrò positiva per la presenza di proteine ma negativa per leucociti, batteri e nitriti. L’ecografia fece risaltare una massa ipodensa nel rene sinistro che si ipotizzava fosse un ascesso o una reazione callosa alla nefrostomia. L’urinocoltura era negativa, il ragazzo non ebbe alcun dolore al fianco sinistro per 24 ore, non manifestava febbre, nausea e vomito. Venne quindi dimesso con la prescrizione di una terapia con cefnidir. Non si verificarono riprese di sintomi e la condizione renale risultò stabile nel follow-up;
- Una donna di 31 anni, che aveva una storia di secrezione vaginale maleodorante, si recò in un laboratorio d’analisi, dove effettuò l’esame emocromocitometrico e l’analisi di un tampone vaginale. Dall’emocromo la paziente aveva 8900 leucociti/μl, di cui 66% di granulociti neutrofili, 29% di linfociti, 4% di monociti e 1% di eosinofili. L’analisi microscopica del tampone vaginale rivelò la presenza di pochi granulociti neutrofili, cellule epiteliali e bacilli Gram-negativi, mentre la semina del campione su agar sangue e agar MacConkey portò alla crescita rispettivamente di colonie grigie e non emolitiche, e colonie rosa lattosio fermentanti. Il microorganismo fu identificato come L. adecarboxylata mediante Microscan autoSCAN 4, ed era resistente alla fosfomicina. La ragazza era immunocompetente (dal momento che la conta dei linfociti CD4 era 1000 al μl) e, grazie a una terapia con moxifloxacina 400 mg per dieci giorni, guarì senza alcuna complicazione;
- Un uomo di 50 anni presentava un ascesso al gluteo la cui temperatura era di 102° F. L’esame del sangue evidenziò una conta leucocitaria elevata (11600 cellule/μl con 75% di neutrofili, 20% di linfociti, 3% di monociti e 2% di eosinofili), mentre all’osservazione microscopica del campione di pus si constatò la presenza di poche cellule epiteliali, una grande quantità di neutrofili e di bacilli Gram-negativi. Su agar sangue e agar MacConkey comparvero delle colonie uguali a quelle descritte nel caso precedente, e il microrganismo risultò essere L. adecarboxylata. Anche questo paziente aveva il sistema immunitario forte (899 linfociti T CD4/μl), e guarì in seguito a un trattamento con doxiciclina 100 mg per dieci giorni;
- Un uomo di 83 anni fu ricoverato in ospedale con una polmonite da aspirazione. Precedentemente aveva sofferto infarto cerebrale, tumore prostatico di basso grado non trattato ed emiplegia dovuta a una lesione del midollo spinale. Venne curato e i suoi sintomi si risolsero durante la riabilitazione. Ciononostante, all’improvviso sviluppò febbre, brividi e stato mentale alterato; la temperatura era di 39,6° C, la pressione ematica 108/63 mmHg, la frequenza respiratoria di 34 respiri al minuto e il polso di 121 battiti al minuto. Gli esami di laboratorio mostrarono valori alti degli enzimi epatici, dei prodotti di degradazione del fibrinogeno, del tempo di tromboplastina parziale attivato (aPTT) e del tempo di protrombina (PT). Venne subito sottoposto a una terapia antibiotica intravenosa, in quanto si sospettava la sepsi. L’emocoltura risultò positiva per bacilli Gram-negativi lattosio fermentanti (Fig. 5), identificati come L. adecarboxylata tramite la suscettibilità antibiotica e il sequenziamento del gene codificante per la subunità ribosomiale 16S (16S rRNA). Grazie a trattamenti esaurienti, il paziente migliorò;

- Un uomo di 81 anni si presentò al pronto soccorso lamentando gonfiore e arrossamento alla gamba destra (senza dolore) e riferì che una settimana prima aveva liberato la sua cantina dalle acque alluvionali dopo l’uragano Irene dell’agosto 2011. Non ricordava se aveva ferite o abrasioni alla gamba e aveva una storia clinica che comprendeva diabete poco controllato, gotta e ipertensione. Il giorno che giunse al pronto soccorso aveva una temperatura di 36,7° C, polso di 101 battiti al minuto, pressione ematica di 120/73 mmHg e saturazione dell’ossigeno al 99%. Dalle analisi di laboratorio venne fuori una conta leucocitaria di 25960 cellule/μl e un’emoglobina glicata di 6,9%.
All’esame fisico la gamba destra (precisamente a livello della coscia) era calda, eritematosa e gonfia, e sul malleolo laterale era presente una bolla violacea di 5 mm. Nonostante la sensibilità della superficie dorsale del piede sinistro fosse ridotta, il paziente riusciva a muovere le dita.
Il terzo giorno la semina di un tampone da ferita ebbe come risultato la crescita di poche colonie di L. adecarboxylata insieme a molte colonie di Staphlycoccus aureus e Streptococcus pyogenes; l’esame microscopico rilevò una grande quantità di cocchi Gram-positivi. All’inizio si pensava che si trattasse di fascite necrotizzante, e poiché il paziente era venuto a contatto con l’acqua e si era trovato vicino alla baia di Chesapeake, si sospettava il coinvolgimento di Vibrio vulnificus e Aeromonas hydrophila. Tale ipotesi fu scartata grazie al basso punteggio dell’indice LRINEC (indicatore di rischio di laboratorio per il punteggio della fascite necrotizzante), che consente di distinguere tra la fascite necrotizzante e le altre infezioni dei tessuti molli. L’uomo venne trattato inizialmente con clindamicina, vancomicina e ceftazidima, per poi, una volta identificato l’agente eziologico, passare a una terapia con ceftriaxone accoppiato alla clindamicina;
- Una donna di 51 anni, senza alcun problema al sistema immunitario, arrivò al pronto soccorso accusando nausea, vomito e malessere da alcuni giorni. Negò l’assunzione di alcol, droghe o tabacco. All’esame fisico il suo addome era globalmente sensibile, ancor di più nell’area epigastrica; la temperatura era di 37° C, il polso di 110 battiti al minuto, la pressione ematica di 75/50 mmHg e la saturazione dell’ossigeno di 91%. I test per l’HIV e l’epatite risultarono negativi, mentre l’ecografia del fegato e della cistifellea mise in evidenza multipli calcoli immobili, un ispessimento della parete della cistifellea di 0,99 cm (Fig. 6) e un accumulo moderato di liquido pericolecistico. Era affetta da colecistite. Iniziarono perciò i trattamenti con antibiotici ad ampio spettro, la somministrazione con liquidi cristalloidi e di farmaci vasopressori, al fine di mantenere la pressione ematica. Qualche ora dopo la paziente andò incontro a insufficienza respiratoria che necessitò di intubazione endotracheale. Venne eseguito un drenaggio della cistifellea e la coltura dei fluidi biliari portò alla crescita di colonie di L. adecarboxylata. Il secondo giorno la signora sviluppò una coagulazione intravascolare disseminata (CID) dovuta a shock settico e un’insufficienza epatica; ricevette quindi trasfusioni di plasma e globuli rossi, e trattamenti con antibiotici e vasopressori. Oltre a ciò, venne sottoposta a emodialisi a causa dell’insufficienza renale secondaria allo shock settico. Il quarto giorno la donna morì per un arresto cardiaco.

Identificazione e terapia
L’approccio diagnostico per le sospette infezioni da L. adecarboxylata consiste in multiple analisi su uno specifico campione che può essere sangue, espettorato, urine, tampone da ferita, pus, liquido peritoneale, tessuto della cistifellea e tessuto cardiaco. Si esegue l’osservazione microscopica, l’esame colturale sui due terreni già nominati in precedenza e le analisi biochimiche. Queste ultime riguardano il test dell’esculina, il test della produzione di indolo, la prova della riduzione dei nitrati e il saggio della fermentazione del D-glucosio, del D-mannitolo, dell’L-arabinosio e del lattosio.
Un’ulteriore indagine è la sensibilità agli antibiotici; il microorganismo si dimostra sensibile ad antibiotici come gentamicina, amicacina, cefazolina, ciprofloxacina, imipenem e cloramfenicolo, mentre è resistente a penicillina G, oxacillina, eritromicina, rifampicina, fosfomicina, chetolidi, claritromicina, roxitromicina, linezolid e lincosamidi. Se il volume di lavoro è alto, tale analisi può essere effettuata attraverso il sistema Microscan WalkAway (Fig. 7).

Nel caso ci fosse la necessità di metodiche più sensibili, è possibile ricorrere all’analisi molecolare mediante la reazione a catena della DNA polimerasi (PCR) e il sequenziamento del gene 16S rRNA, oppure alla spettrometria di massa con MALDI-TOF (Matrix Assisted Laser Desorption/Ionization-Time of Flight).
Per quanto concerne la terapia, si fonda principalmente sull’impiego di specifici antibiotici, tra cui clindamicina, ceftrixone, ciprofloxacina, doxiciclina e moxifloxacina.
Approfondimento sulla resistenza antibiotica
Per concludere l’articolo, è interessante citare due studi riguardanti la resistenza di L. adecarboxylata ad alcuni antibiotici. Un lavoro del 2019, pubblicato su Frontiers of Microbiology, descrive l’isolamento di un ceppo del batterio dalla flora intestinale di un uomo cinese di 60 anni. Tale ceppo (chiamato Z96-1) è contraddistinto dalla presenza di sette plasmidi contenenti quattro specifici geni, ovvero bla-IMP-4, aac(3)-Ib, qnrS1 e catB4, i quali conferiscono resistenza rispettivamente a carbapenemici, aminoglicosidi, fluorochinoloni e fenicolo. In aggiunta a ciò, gli scienziati identificarono anche un gene della resistenza alla colistina, mcr-4.3, che però non rendeva il batterio tollerante verso tale antibiotico. I ricercatori effettuarono un’analisi comparativa, mediante il software Easyfig, tra il plasmide pMCR-Z96-1 del ceppo Z96-1, il plasmide pMCR_R3445, isolato da un ceppo di Salmonella, e il plasmide pEn_MCR4, isolato da Enterobacter cloacae (Fig. 8). Mentre in pMCR-Z96-1 e pEn_MCR4 era presente il gene mcr-4.3, pMCR_R3445 includeva il gene mcr-4.1. Si scoprì che mcr-4.3 conteneva due sostituzioni amminoacidiche se comparato con mcr-4.1, ma esibiva il 100% di identità nucleotidica con mcr-4.3 di pEn_MCR4. È possibile che mcr-4.3 derivi da mcr-4.1 attraverso mutazioni che silenziano la resistenza alla colistina. Questa osservazione è coerente con la conclusione che mcr-4.3 è una forma inattiva di mcr-4.1, e che le due mutazioni sono responsabili della ridotta attività enzimatica.

In un lavoro del 2003, pubblicato su Journal of Clinical Microbiology, un gruppo di ricercatori espose l’isolamento di un ceppo di L. adecarboxylata da un uomo di 58 anni affetto da leucemia acuta mieloide, ricoverato presso l’unità di ematologia dell’ospedale universitario di Verona. Tale ceppo batterico produceva delle beta-lattamasi ad ampio spettro, che gli consentivano di idrolizzare antibiotici come ceftazidima, cefotaxime e aztreonam.
Gli scienziati verificarono la presenza dei geni di resistenza, ossia bla-TEM o bla-SHV, mediante PCR e sequenziamento, e identificarono bla-SHV come il gene della lattamasi SHV-12. Questo venne amplificato tramite PCR e inserito all’interno di un vettore. I prodotti della ligazioni furono usati per trasformare dei ceppi di Escherichia Coli. In seguito, i ricercatori eseguirono l’antibiogramma per vari antibiotici (penicillina G, ampicillina, aztreonam, ciprofloxacina, gentamicina, amoxicillina, imipenem) sia sul ceppo di L. adecarboxylata che sul ceppo di E. Coli trasformato, e dimostrarono che la minima concentrazione inibente (MIC) era la stessa per entrambi i batteri. L’identificazione di questo gene conferma la diffusione estesa in Italia dell’enzima beta-lattamasi, che raffigura una delle varianti più comuni trovata in molti ospedali e in varie specie di Enterobacteriaceae secondo un sondaggio nazionale italiano del 2002.
Fonti
- Mokkapati Anuradha. 2014. “Leclercia Adecarboxylata Isolation: Case Reports and Review”, Journal of Clinical and Diagnostic Research
- Jonathan Keyes, Evan P. Johnson, Monica Epelman, Adriana Cadilla, Syed Ali. 2020. “Leclercia adecarboxylata: An Emerging Pathogen Among Pediatric Infections”, Cureus
- H. Matsuura and S. Sugiyama. 2018. “Sepsis and Leclercia adecarboxylata”, QJM: An International Journal of Medicine
- Nooraldin Merza, John Lung, Ahmed Taha, Ahmed Qasim, Jill Frost, and Tarek Naguib. 2019. “Leclercia adecarboxylata Cholecystitis with Septic Shock in Immunocompetent Patient”, Hindawi
- Carlos A. Botero-García, Carlos H. Gómez, Juan S. Bravo, Luz Angela Pescador Vargas. 2017. “Leclercia adecarboxylata, a rare cause of soft tissue infections in immunocompromised patients, case report and review of the literature”, Infectio
- Malene Roed Spiegelhauer, Peter Fruergaard Andersen, Tove Havnhøj Frandsen, Rie Louise Møller Nordestgaard and Leif Percival Andersen. 2018. “Leclercia adecarboxylata: a case report and literature review of 74 cases demonstrating its pathogenicity in immunocompromised patients”, Infectious Diseases
- Vernissia Tam and Seema Nayak. 2012. “Isolation of Leclercia adecarboxylata from a wound infection after exposure to hurricane-related floodwater”, BMJ Case Reports
- Qiaoling Sun, Hanyu Wang, Lingbin Shu, Ning Dong, Fan Yang, Hongwei Zhou, Sheng Chen and Rong Zhang. 2019. “Leclercia adecarboxylata From Human Gut Flora Carries mcr-4.3 and blaIMP-4-Bearing Plasmids”, Frontiers of Microbiology
- Annarita Mazzariol, Jessica Zuliani, Roberta Fontana, and Giuseppe Cornaglia. 2003. “Isolation from Blood Culture of a Leclercia adecarboxylata Strain Producing an SHV-12 Extended-Spectrum Beta-Lactamase”, Journal of Clinical Microbiology