Caratteristiche
Morganella morganii (precedentemente denominata Proteus morganii) (Fig. 1) è un bacillo Gram-negativo pleomorfo, aerobio facoltativo, catalasi positivo, ossidasi negativo, asporigeno e mobile per flagelli peritrichi. Inoltre, fermenta il glucosio e il mannosio (non il lattosio), riduce i nitrati a nitriti ed esprime l’enzima ureasi, che scinde l’urea in ammoniaca e anidride carbonica. Possiede un genoma di circa 4.000.000 paia di basi (pb) e i geni codificanti per proteine sono pressappoco 4.000 mila

M. morganii raffigura l’unica specie inclusa nel genere Morganella, appartiene alla famiglia Enterobacteriaceae ed è strettamente correlata ai batteri del genere Proteus. C’è da dire che nella specie M. morganii rientrano due sottospecie, ovvero M. morganii morganii e M. morganii sibonii. Si tratta di un batterio commensale che risiede nel tratto gastroenterico di diversi mammiferi, compreso l’essere umano, e dei rettili, ed è ampiamente distribuito nell’ambiente. Alcuni animali domestici e selvatici in cui è stata identificata sono i polli, i conigli, i vitelli, i maialini da latte, i giaguari, gli elefanti, i porcellini d’India e i delfini.
Il nome del genere deriva dal batteriologo britannico H. de R. Morgan, in quale, nel 1906, isolò il microorganismo dalle feci di bambini affetti dalla cosiddetta “diarrea estiva”, causata da uno squilibrio della flora intestinale. Dal 1970 M. morganii è considerato un agente eziologico di infezioni nosocomiali negli adulti e un patogeno opportunista responsabile di infezioni delle vie urinarie, delle ferite chirurgiche e del sistema nervoso centrale, peritoniti, endoftalmiti, sepsi, ascessi, celluliti, diarrea e batteriemia.
Filogenesi
| Dominio | Prokaryota |
| Regno | Bacteria |
| Phylum | Proteobacteria |
| Classe | Gammaproteobacteria |
| Ordine | Enterobacterales |
| Famiglia | Enterobacteriaceae |
| Genere | Morganella |
| Specie | M. morganii |
Morfologia delle colonie
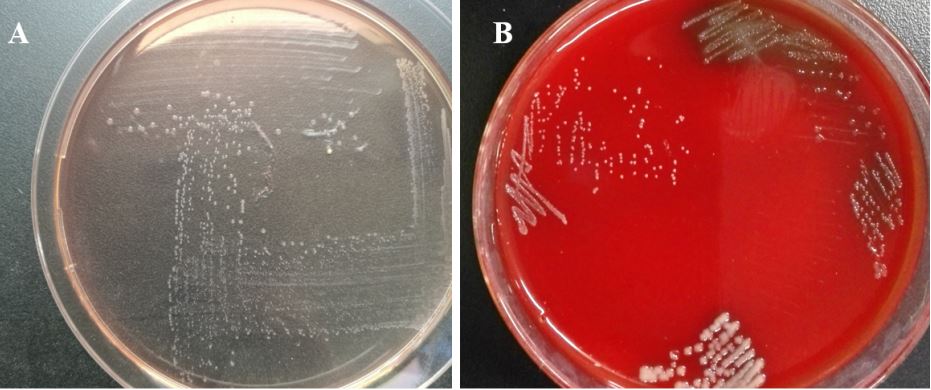
Su agar sangue M. morganii genera delle colonie circolari, opache, biancastre e attorniate da un leggero alone di beta emolisi, mentre la crescita su agar MacConkey porta alla formazione di colonie piccole, tonde e traslucide, il cui colore va dal grigio al rosa pallido (Fig. 2). Normalmente l’isolamento di questo batterio avviene da campioni polimicrobici e prevede l’impiego di terreni selettivi per gli enterobatteri.
Patogenesi
Come abbiamo accennato all’inizio, M. morganii rientra nella normale flora commensale dell’intestino, quindi è un componente del microbiota; tuttavia, ci sono molteplici circostanze che facilitano l’insorgenza di malattie, tra cui indebolimento del sistema immunitario (microorganismo opportunista), impiego improprio di antibiotici beta-lattamici, diabete mellito, età avanzata, ferite chirurgiche, esposizione al momento della nascita, e ascessi e infezioni dei tessuti molli conseguenti a morsi di serpenti (dal momento che il batterio risiede anche nella cavità orale di questi rettili).
Bisogna sottolineare che le manifestazioni cliniche dell’infezione da M. morganii sono abbastanza aspecifiche e, senza una diagnosi appropriata, non vengono connesse al batterio. Tra i vari sintomi abbiamo:
- Una sindrome simile alla colite caratterizzata da diarrea, sangue nelle feci, dolori addominali, febbre, nausea e vomito;
- Cistite, con bruciore durante la minzione, urine dall’odore sgradevole e dal colore intenso, e dolore pelvico. Quest’ultimo riguarda soprattutto le donne;
- Febbre lieve connessa alla presenza del batterio nel flusso ematico (batteriemia) in seguito a ferite o interventi chirurgici;
Se non si attua una terapia idonea, l’infezione si può aggravare ed evolvere in setticemia, che è distinta da ipertermia (oltre i 38° C) o ipotermia (sotto i 36° C), tachicardia (più di 90 battiti al minuto) e tachipnea (più di 20 respiri al minuto). In alcune situazioni la setticemia può essere associata a brividi, nausea, vomito, ipotensione e disturbi sensoriali.
Descriviamo ora un episodio di infezione perinatale e uno di sepsi. Il primo riguarda una donna di 35 anni che, alla ventisettesima settimana di gestazione, era stata trasferita all’ospedale della Marshall University (Huntington, USA) a causa di una rottura precoce della membrana amniotica. Poiché presentava una cervice corta, sei settimane prima le era stato applicato un cerchiaggio cervicale. La donna fumava occasionalmente marijuana, non beveva alcolici e non faceva uso di droghe, e al suo arrivo in ospedale i suoi segni vitali erano stabili. Dalle analisi ematiche risultò una conta leucocitaria di 9,7 x 109 cellule al litro e 13,5% di emoglobina; l’esame delle urine, la ricerca di droghe nelle urine, il dosaggio di anticorpi contro l’HIV, le analisi molecolari per Neisseria gonorrhoeae e Chlamydia trachomatis erano tutte negative.
I medici la sottoposero a una terapia profilattica endovenosa con ampicillina 2000 mg ogni sei ore per un lasso di tempo di 48 ore; il secondo giorno le rimossero il cerchiaggio e la monitorarono continuamente. Il terzo giorno la donna aveva i leucociti aumentati a 11,4 x 109/L senza però una linea di febbre, la cervice era intatta e la frequenza cardiaca fetale era normale. Quando i medici scoprirono una vaginosi batterica, la paziente ricevette metronidazolo, e nel momento in cui l’urinocoltura si rivelò positiva a M. morganii, iniziò una terapia con nitrofurantoina. Il giorno successivo la giovane aveva la febbre alta (39,5° C), i globuli bianchi erano saliti ulteriormente (17,1 x 109/L) e l’acido lattico era elevato (4 mmol/L). Lo stesso giorno i dottori attuarono un parto cesareo d’emergenza, poiché il feto era bradicardico; nonostante i tentativi di rianimazione cardiopolmonare, il neonato non sopravvisse. Le analisi colturali del sangue e della placenta indicarono la presenza di M. morganii resistente a vari antibiotici. La donna, che era andata incontro a sepsi, venne curata con piperacillina e tazobactam.
Il secondo caso, avvenuto in Uruguay, ha come protagonista un uomo di 24 anni con una storia di ipertensione e insufficienza renale che richiedeva la dialisi. Otto mesi prima di presentarsi all’ospedale, egli aveva subito un trapianto di rene, che aveva avuto delle complicazione, ovvero incontinenza urinaria e infezione delle vie urinarie da Enterobacter cloacae, che fu curata con piperacillina e tazobactam. Quando arrivò al pronto soccorso, il giovane lamentava febbre e disuria, aveva una frequenza cardiaca di 100 battiti al minuto ed era itterico. L’analisi delle urine era positiva a nitriti, emoglobina ed esterasi leucocitaria, e l’esame del sedimento rivelò la presenza di leucociti ed eritrociti. Gli esami ematochimici riportarono alti livelli dei marcatori di infiammazione come la proteina C reattiva (129 mg/dl) e la procalcitonina (38 ng/ml), pancitopenia (diminuzione di tutte le cellule del sangue), e disfunzione renale ed epatica. Inoltre, l’urinocoltura e l’emocoltura mostrarono la crescita di un ceppo M. morganii che esprimeva il gene NMD-1 (New Delhi metallo-β-lattamasi) ed era suscettibile solo alla fosfomicina. Considerando i risultati, i medici sottoposero il paziente a una terapia con fosfomicina e meropenem, che permise la guarigione e la ripresa della funzione renale
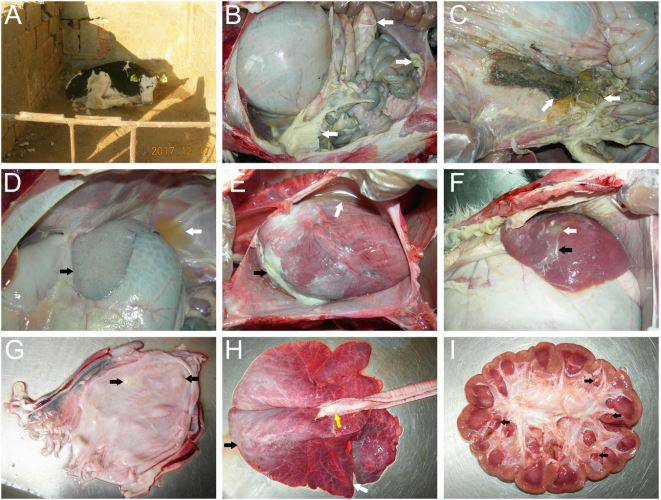
Le patologie dovute a M. morganii non sono solamente umane, bensì colpiscono anche gli animali, come quelli elencati all’inizio. A tal proposito è interessante illustrare un caso di infezione da M. morganii morganii, risalente al 2017, che interessò i bovini di una fattoria situata in Cina, a Tai’an, nella provincia di Shandong. La malattia comportò un tasso di mortalità elevato e gravi lesioni patologiche.
La fattoria possedeva 200 bovini e 100 vitelli; questi ultimi manifestavano depressione, perdita di appetito, paralisi (Fig. 3A), evacuazione di feci somiglianti a uova bianche miste a materiale flocculante biancastro. Cinque giorni dopo l’inizio della malattia, 8 vitelli su 14 morirono, mentre i sopravvissuti erano emaciati e presentavano ritardo nella crescita. I tentativi di curare gli animali infetti con vari antibiotici (gentamicina, penicillina, sulfadiazina) non ebbero alcun effetto. I saggi di sensibilità antibiotica, mediante il metodo di diffusione Kirby-Bauer, rivelarono che il batterio era resistente alla sulfadiazina, alla penicillina e al florfenicolo, e mediamente sensibile alla gentamicina. Gli esami autoptici sui bovini deceduti mostrarono coaguli suppurativi fibrinosi e giallastri nella cavità addominale (Fig. 3B), fuoriuscita del contenuto gastrico da un’ulcera sulla bolla dello stomaco (Fig. 3C), raccolta di materiale proteico biancastro e fibrinoso sulla superficie della milza (Fig. 3D), versamento giallastro nel pericardio ed essudato settico nell’epicardio (Fig. 3E), ascesso epatico con essudato fibrinoso e purulento (presenza di pus) (Fig. 3F), materiale biancastro e purulento nella cistifellea (Fig. 3G), iperplasia (aumento del numero di cellule) del tessuto connettivo nel lobo polmonare anteriore, gonfiore nel lobo polmonare posteriore e accumulo di fluido schiumoso nella trachea (Fig. 3H), e infine noduli suppurativi giallastri nelle papille renali (Fig. 3I).
Metodi di identificazione
La diagnosi di malattie da M. morganii consiste in particolare nell’esecuzione di analisi microscopica dopo colorazione di Gram, esame colturale mediante semina su agar sangue e agar MacConkey, e saggi biochimici come il test della catalasi, il test della produzione di indolo (sottoprodotto della digestione dell’amminoacido triptofano) e il test della fermentazione di glucosio e mannosio. Nel caso in cui ci si trova di fronte a cistite, la valutazione del pH urinario può aiutare, dal momento che le infezioni del tratto urinario dovute a M. morganii sono spesso associate a urine alcaline.
È possibile effettuare anche analisi molecolari basate sull’amplificazione del DNA tramite PCR. Tornando al caso di infezione dei bovini della fattoria a Tai’an, gli scienziati avevano amplificato il gene codificante per la subunità ribosomiale 16S (16S rDNA); dipoi la sequenza amplificata era stata clonata in plasmidi, sequenziata e comparata con altre sequenze contenute nel database GenBank.
Terapia e resistenza agli antibiotici
Per quanto concerne il trattamento delle infezioni da M. morganii, si ricorre a determinati antibiotici, cioè la ticarcillina, la piperacillina, la ciprofloxacina e le cefalosporine di terza e quarta generazione. Tra il 2001 e il 2004, all’ospedale universitario di Heraklion, a Creta, venne condotto uno studio retrospettivo su 24 pazienti che presentavano varie patologie; da ognuno di essi furono prelevati dei campioni, da cui fu isolato il batterio. Il trattamento con gli antibiotici sopraelencati si rivelò efficace nel 92% dei pazienti.
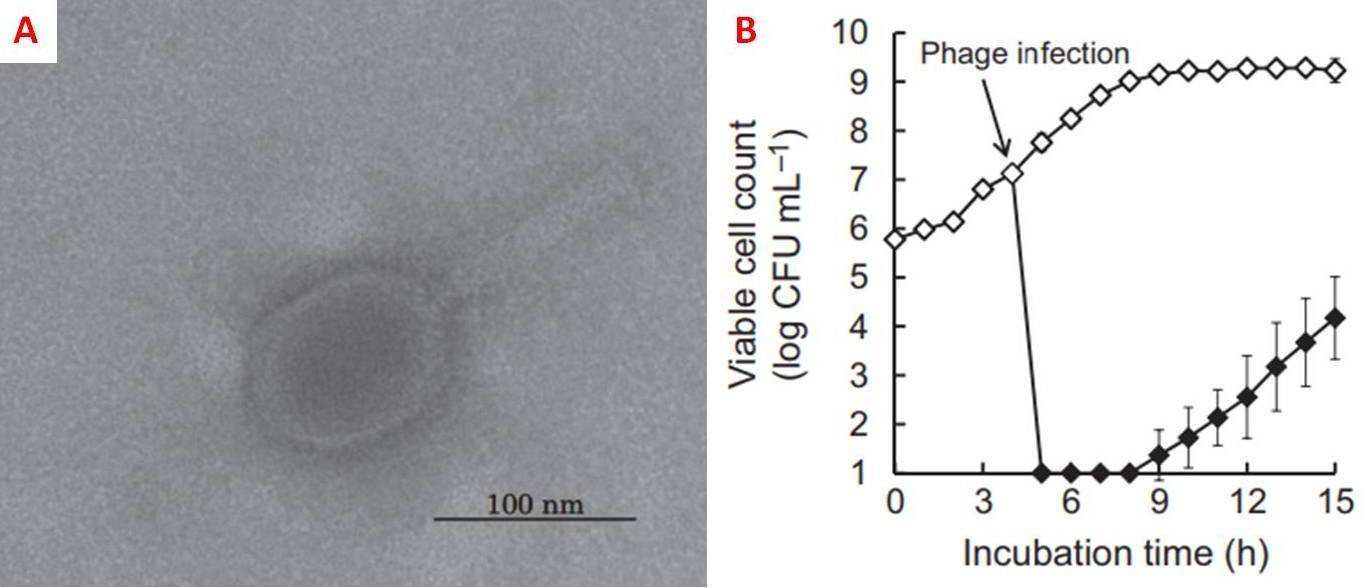
Un’alternativa agli antibiotici potrebbero essere i batteriofagi, ovvero i virus che parassitano i batteri: in uno studio del 2014, pubblicato su FEMS (Federation of European Microbiological Societies), un gruppo di ricercatori caratterizzò un batteriofago, detto FSP1, identificato come appartenente alla famiglia Myoviridae (Fig. 4A). Si notò che FSP1 infettava specificatamente M. morganii, verso cui esercitava una cospicua attività litica: infatti, il numero di cellule batteriche trattate con FSP1 si riduceva notevolmente (Fig. 4B). I risultati di questo lavoro suggeriscono che FSP1 potrebbe essere impiegato come agente di biocontrollo nella cura di infezioni da M. morganii o nella decontaminazione degli alimenti.
Occorre ricordare che M. morganii è resistente a molteplici categorie di antibiotici, come i beta-lattamici (penicillina, ampicillina, oxacillina), gli amminoglicosidi (gentamicina, tobramicina, canamicina), i macrolidi (eritromicina), le cefalosporine di prima e seconda generazione, la colistina, i lincosamidi e la polimixina B. Sono emersi anche ceppi altamente resistenti alle cefalosporine di terza generazione.
La tolleranza verso gli antibiotici è legata all’espressione di specifici geni codificanti per enzimi, ad esempio dha-1, ampC e blaOXA-2, che conferiscono resistenza ai beta-lattamici, aphA6, aadA2 e aacA7, che rendono il batterio tollerante verso gli amminoglicosidi, catA1 e catB3, che agiscono sui macrolidi.
Fonti
- Nicoletti Giuseppe e Mar Nicolosi Vito. 1998. “Dizionario di batteriologia umana normale e patologica. Terza edizione”, Menarini
- Gen Li, Xudong Niu, Shiyu Yuan, Lu Liang, Yongxia Liu, Liping Hu, Jianzhu Liu and Ziqiang Cheng. 2018. “Emergence of Morganella morganii subsp. morganii in dairy calves, China”, Emerging Microbes & Infections
- Hui Liu, Junmin Zhu, Qiwen Hu, Xiancai Rao. 2016. “Morganella morganii, a non-negligent opportunistic pathogen”, International Journal of Infectious Diseases
- Bin Tian, Dongjie Cai, Xiao Liu, Yulong Zhang, Jianzhu Liu, Mingshu Wang, Ya Wang, Liping Gou, Zhijun Zhong, Jing Fang and Zhicai Zuo. 2020. “Prevalence and characterization of Morganella morganii in beef cattle from Sichuan Province, China”, Research Square
- Verònica Seija, Julio César Medina Presentado, Inés Bado, Romina Papa Ezdra, Noelia Batista, Claudia Gutierrez, Mariana Guirado, Macarena Vidal, Marcelo Nin and Rafael Vignoli. 2014: “Sepsis caused by New Delhi metallo-b-lactamase (blaNDM-1) and qnrD-producing Morganella morganii, treated successfully with fosfomycin and meropenem: case report and literature review”, International Journal of Infectious Diseases
- Gen Li, Xudong Niu, Shiyu Yuan, Lu Liang, Yongxia Liu, Liping Hu, Jianzhu Liu and Ziqiang Cheng. 2018. “Emergence of Morganella morganii subsp. morganii in dairy calves, China”, Emerging Microbes & Infections
- Shogo Yamaki, Takuo Omachi, Yuji Kawai and Koji Yamazaki. 2014. “Characterization of a novel Morganella morganii bacteriophage FSP1 isolated from river water”, FEMS
- Falagas M.E., P.K. Kavvadia, E. Mantadakis, D.P. Kofteridis, I.A. Bliziotis, E. Saloustros, S. Maraki and G. Samonis. 2006. “Morganella morganii infections in General Tertiary Hospital”, Clinical and Epidemiology Study
- http://www.thistle.co.za/pdf_files/education/microbiology/microbiology_legends/Cycle_41/Cycle%2041%20Organism%202%20-%20Morganella%20Morganii.pdf
- http://www.thistle.co.za/pdf_files/education/microbiology/microbiology_legends/Cycle_37/Cycle%2037%20Organism%205%20Morganella%20morganii.pdf
- https://www.nurse24.it/dossier/salute/infezione-morganella-morganii.html
- https://www.pazienti.it/contenuti/malattie/morganella-morganii
- https://notiziefood.it/morganella-batterio-che-tipo-di-organismo-e-cosa-puo-provocare/https://www.cureus.com/articles/28196-a-case-of-morganella-morganii-induced-fetal-demise