Caratteristiche
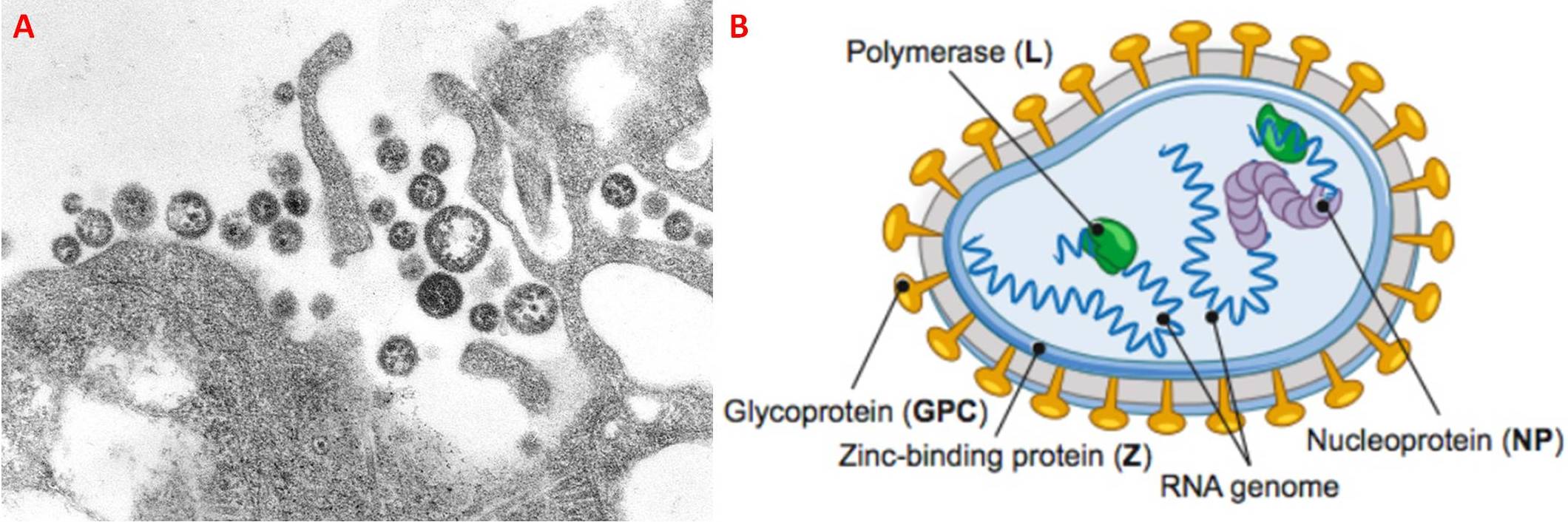
Il Lassa virus (LASV), o Lassa mammarenavirus (LMV), è un virus appartenente alla famiglia Arenaviridae, è dotato di un pericapside sferoidale che misura tra 70 e 150 nm, e contiene un genoma formato da RNA a singolo filamento, composto da un segmento più grande (Large) di circa 7,3 kilobasi (kb) e uno più piccolo (Small) di circa 3,5 kb. A sua volta, il genoma codifica per quattro proteine virali, ossia la proteina con motivi a dita di zinco (Z), l’enzima RNA polimerasi (L), la nucleoproteina (NP) e il precursore della glicoproteina di superficie (GPC o GP) (Fig. 1).
Sovente all’interno del virus è possibile osservare dei granuli elettrondensi, identificati come i ribosomi della cellula ospite, da cui deriva il nome “arena”, che significa sabbia (Fig. 1A).
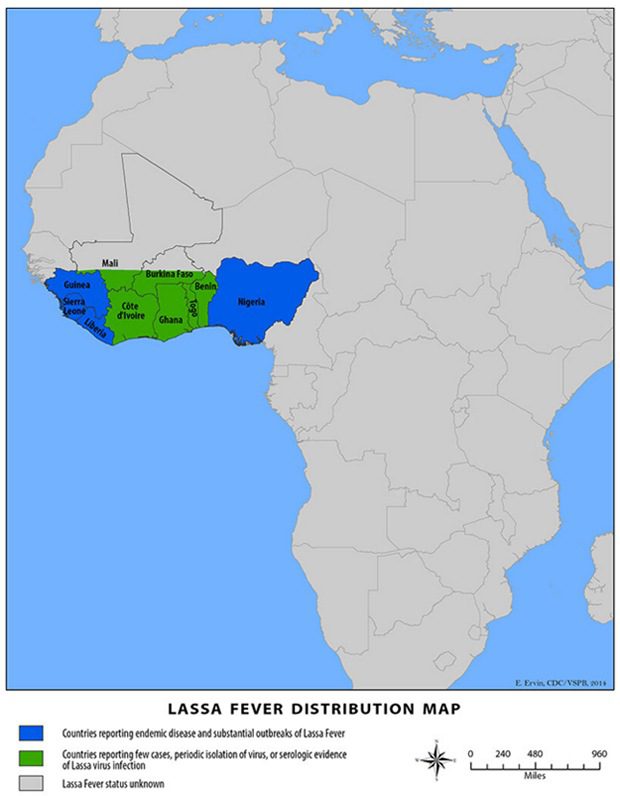
Questo virus raffigura l’agente eziologico della febbre emorragica di Lassa, una grave malattia endemica in Africa occidentale (Nigeria, Sierra Leone, Liberia, Guinea, Gabon, Togo, Benin, Mali e Ghana) (Fig. 2), dove annualmente si verificano più di 300.000-500.000 infezioni e 5000-10.000 casi fatali di febbre di Lassa. Tuttavia, sono stati registrati degli episodi anche negli Stati Uniti d’America e in Europa (Svezia, Germania e Gran Bretagna). Si tratta di una zoonosi, in quanto il virus ha come serbatoio naturale roditori di varie specie, tra cui Mastomys natalensis (topo multimammato), M. erythroleucus (ratto a mammelle multiple) (Fig. 3), Hylomyscus pamfi e Mus baoulei (topo pigmeo), i quali sono notevolmente fecondi, sono abitanti comuni della savana e delle foreste africane, e spesso non mancano all’interno delle abitazioni umane. Questi roditori albergano il virus senza ammalarsi e lo rilasciano attraverso la saliva, le urine e le feci.

La prima descrizione della febbre emorragica da arenavirus risale agli anni 50 con l’isolamento del Junin virus (responsabile della febbre emorragica argentina) nel 1958, seguito dalla scoperta del Machupo virus (responsabile della febbre emorragica boliviana) nel 1965. L’identificazione del Lassa virus avvenne nel 1969, e il nome deriva dal nome della città presente nella regione nigeriana del Borno (Lassa), in cui si registrarono i primi casi.
Filogenesi
| Dominio | Riboviria |
| Regno | Orthornavirae |
| Phylum | Negarnaviricota |
| Subphylum | Polyploviricotina |
| Classe | Ellioviricetes |
| Ordine | Bunyavirales |
| Famiglia | Arenaviridae |
| Genere | Mammarenavirus |
| Specie | Lassa mammarenavirus |
Struttura e replicazione
Il Lassa virus è rivestito da un envelope costituito da un doppio strato lipidico contenente due glicoproteine GP1 e GP2, coinvolte rispettivamente nell’interazione con i recettori cellulari e l’ingresso nella cellula ospite. Queste esibiscono una forma a T e originano dal precursore GP in seguito a un taglio proteolitico da parte di una proteasi. Sotto al pericapside si trova uno strato formato dalla proteina con motivi a dita di zinco (Z), la quale gioca un ruolo fondamentale nell’assemblaggio e nella gemmazione dei nuovi virioni. Nel core del virus sono presenti due complessi di ribonucleoproteine virali (vRNPs) composti dai segmenti genomici virali racchiusi dalla nucleoproteina virale (NP) (Fig. 4A). L’interazione tra la proteina Z e la NP media l’integrazione delle vRNPs nei virioni; i processi di replicazione del genoma virale e trascrizione dei geni richiedono l’enzima RNA-polimerasi-RNA-dipendente (L), associata ai due vRNPs.
Le prime fasi del ciclo biologico del LASV sono l’accostamento tra gli antirecettori virali (GP1 e GP2) e i recettori della cellula ospite, l’ingresso nella cellula mediante endocitosi e la rimozione del rivestimento proteico con conseguente liberazione nel citoplasma del genoma, che andrà incontro a duplicazione, trascrizione e traduzione (Fig. 5).
Il recettore con cui il virus interagisce è rappresentato dalla glicoproteina di membrana alfa-distroglicano, che lega la matrice extracellulare. Questa molecola è espressa su una vasta gamma di cellule, tra cui le cellule dendritiche, i macrofagi, gli endoteliociti e le cellule muscolari scheletriche. Queste ultime, però, non raffigurano il maggiore bersaglio del LASV, e ciò potrebbe essere legato a un blocco dell’adesione e della replicazione del virus.
Il LASV possiede due filamenti di RNA a polarità negativa, uno di maggiori dimensioni, che codifica per la proteina Z e la polimerasi, e uno di lunghezza inferiore, che codifica per la glicoproteina GP e la nucleoproteina. Questi filamenti impiegano la strategia di codifica ambisenso, al fine di dirigere la generazione delle due proteine virali in direzione opposta. La polimerasi avvia la trascrizione dal promotore virale, collocato nella regione non codificante (UTR) presente all’estremità 3’ dell’RNA virale. La trascrizione primaria porta alla sintesi della nucleoproteina e degli RNA messaggeri (mRNA). Il termine della trascrizione si verifica grazie alla regione intergenica (IGR), una struttura ad ansa presente in entrambi i filamenti di RNA, situata in mezzo ai due geni virali. Successivamente la polimerasi si muove attraverso la regione IGR allo scopo di creare una copia completa dei due RNA virali antigenomici, i quali fungono da stampi per la produzione degli mRNA codificanti per le proteine GP e Z. La figura 4B riassume indicativamente i processi di replicazione, trascrizione e traduzione del genoma virale.
L’intero ciclo biologico del virus si compie nel citoplasma della cellula infetta. Una volta completati la sintesi e l’assemblaggio delle proteine virali, i nuovi virioni sono rilasciati all’esterno mediante gemmazione, prendendo una porzione della membrana cellulare, dalla quale origine il pericapside (Fig. 5).


Patogenesi
Il contagio da parte del Lassa virus può avvenire in svariati modi, ovvero tramite il contatto con feci e urine degli animali serbatoi, il contatto con sangue, urine, feci e secrezioni corporee di persone affette, l’ingestione di acqua o cibi inquinati da escrementi di roditori portatori del virus, l’infezione di ferite o piaghe, la manipolazione di oggetti contaminati, l’inalazione di aerosol contenenti il virus. La trasmissione da persona a persona può verificarsi anche mediante rapporti sessuali.
La febbre di Lassa non ha distinzioni dal punto di vista dell’età e del sesso, e colpisce soprattutto gli individui che risiedono in aree campestri abitate da roditori del genere Mastomys. Il rischio aumenta nelle comunità caratterizzate da assembramento e igiene inadeguata. Nell’80% degli episodi di infezione, le persone colpite sono asintomatiche o mostrano sintomi lievi.
La patologia è distinta da un periodo di incubazione che va da 1 a 3 settimane, e insorge con sintomi aspecifici, cioè febbre, debolezza, mal di gola con formazione di chiazze di essudato bianco o giallastro sulle tonsille, malessere, tosse, cefalea, dolore toracico, mialgia e artralgia. Questi segni sono seguiti da manifestazioni a livello dell’apparato gastroenterico, tra cui dolore addominale, nausea, vomito, diarrea ed epigastralgia.
Nei casi più critici, trascorsa la prima settimana compaiono edema facciale, emorragie nasali, orali, vaginali e gastrointestinali, versamento pleurico, shock, coinvolgimento neurologico (perdita dell’udito, tremori ed encefalite), insufficienza multi-organo, leucopenia (diminuzione dei globuli bianchi), trombocitopenia (riduzione delle piastrine) e proteinuria (presenza di proteine nelle urine). In seguito possono presentarsi disorientamento, convulsioni e coma. Il decesso avviene in un lasso di tempo di 14 giorni dalla comparsa dei segni clinici. Il tasso di mortalità è pressappoco dell’1%, anche se nei casi più severi può arrivare al 15-20%. Tali valori salgono ulteriormente durante le epidemie, fino a interessare il 50% delle persone ospedalizzate.
La maggioranza degli individui affetti (60-80%) presenta una pressione sistolica minore di 90 mmHg e relativa bradicardia. Nel 10-30% i pazienti sono colpiti da ingrossamento del volto e del collo e gonfiore della congiuntiva, mentre circa un terzo delle persone che sopravvivono può andare incontro a complicazioni come la sordità neurosensoriale, che di frequente è duratura.
Nella fase di guarigione è possibile osservare perdita dei capelli e problemi temporanei della deambulazione.
La febbre di Lassa è notevolmente pericolosa negli stadi avanzati della gestazione (specialmente durante il terzo trimestre) e può comportare la morte della madre e/o la perdita del feto. Ulteriori fattori che rendono la prognosi sfavorevole sono lo shock, le emorragie, i sintomi neurologici, l’alta viremia e i livelli dell’enzima epatico aspartato amminotransferasi maggiori di 150 IU/L.
Metodi di identificazione
Diagnosticare la febbre di Lassa non è un’operazione semplice, dal momento che le manifestazioni cliniche si confondono con quelle di altre malattie tropicali. È importante, quindi, riuscire a distinguere la febbre di Lassa da altre febbri emorragiche, come le infezioni da virus Ebola e Marburg, e da febbri indotte da altri microorganismi (malaria, leptospirosi, febbre tifoide, febbre gialla, brucellosi).
La diagnosi della febbre Lassa può essere supportata con diversi esami di laboratorio, tuttavia l’accertamento definitivo richiede indagini che sono disponibili esclusivamente in laboratori altamente specializzati con livello di biosicurezza 4 (indicato per lavorare con agenti pericolosi ad alto rischio di trasmissione per via aerea), in cui i campioni infetti vengono manipolati con estrema cura e attenzione (Fig. 6).

Per identificare il LASV vengono si usano le seguenti tecniche:
- L’isolamento del virus in colture cellulari, impiegando la linea cellulare Vero, ottenuta da cellule epiteliali renali estratte dal primate cercopiteco grigioverde. Le cellule sono disposte a formare un monostrato confluente, e subiscono un effetto citopatico lampante da parte del virus. La metodica consiste nell’inculare le cellule con siero, liquido cerebrospinale, liquido pleurico o urine. Nonostante questo metodo sia il più sensibile, si adopera solo a scopo di ricerca;
- Esami sierologici per la ricerca degli anticorpi, come il saggio immuno-assorbente legato a un enzima (ELISA) e l’immunofluorescenza indiretta (IFA);
- Ricerca del genoma virale mediante retro-trascrizione e amplificazione mediante PCR.
Oltre a questi test, è opportuno eseguire analisi epatiche, delle urine e un emocromo completo, poiché nella febbre di Lassa ci può essere una proteinuria massiva, e gli enzimi epatici AST (aspartato amminotransferasi) e ALT (alanina amminotransferasi) sono elevati.
Terapia e profilassi
Il farmaco utilizzato per il trattamento della febbre di Lassa è la ribavirina, un analogo della guanosina che agisce interferendo con la replicazione dell’RNA virale; questo farmaco viene somministrato per via endovenosa, con una dose di 30 mg/kg per due giorni, dopo 16 mg/kg per 4 giorni, e infine 8 mg/kg per 6 giorni. In aggiunta a ciò, è inclusa una terapia di supporto che consiste in trasfusioni, correzione degli squilibri idroelettrolitici e somministrazione di paracetamolo. Nel caso in cui la persona affetta sia una donna incinta, l’aborto abbassa il rischio di morte della madre.
Per prevenire l’infezione da Lassa virus, è importante adoperare dispositivi di protezione adeguati e misure per l’isolamento aereo (impiego di guanti, occhiali protettivi, maschere ad alta funzionalità, una camera a pressione negativa, respiratori con filtro a pressione positiva), detergere le superfici contaminate con specifici prodotti (ipoclorito di sodio allo 0,5%, fenolo allo 0,5% e formalina al 10% sono ottimi per inattivare il virus), e tenere sotto controllo i contatti quando si assistono i pazienti malati.
Quando si viaggia nelle aree endemiche, bisogna ricordarsi di non ingerire acqua o cibi potenzialmente contaminati. In queste zone sarebbe utile introdurre delle strategie di educazione sanitaria per le persone residenti, al fine di minimizzare il contatto con i roditori serbatoi. Tuttavia, la prevenzione a largo raggio è irrealizzabile nelle regione endemiche dell’Africa occidentale, quindi la migliore arma di prevenzione è il vaccino, che però ancora non è disponibile. Comunque, un gruppo di scienziati dell’Istituto Pasteur stanno lavorando per raggiungere tale obiettivo: essi hanno progettato due vaccini basati su virus vivi e attenuati, modificati per esprimere gli antigeni del LASV, ossia un ceppo ricombinante del virus del morbillo, che ha già fornito dei risultati soddisfacenti nei trial clinici per il virus chikungunya, e un Mopeia virus ricombinante, che è strettamente correlato con il LASV ma non è patogeno per gli esseri umani. I ricercatori hanno comparato l’efficacia di questi due vaccini sui modelli animali, e affermano che sono ben tollerati e inducono una protezione verso il LASV dopo una singola somministrazione, differendo nei livelli di efficacia. Quello che si è dimostrato più idoneo è il morbillivirus esprimente le proteine del LASV, che è stato selezionato dal CEPI (Coalition for Epidemic Preparedness Innovations) per entrare nei test clinici sugli esseri umani.
Fonti
- O. Ogbua, E. Ajuluchukwub & C. J. Uneke. 2007. “Lassa fever in West African sub-region: an overview”, J Vect Borne Dis
- Daniel R. Perez . 2017.“Plasmid-Based Reverse Genetics of Influenza A Virus”, Methods in Molecular Biology
- J Daniel Kelly, M Bailor Barrie, Rachel A Ross, Brian A Temple, Lina M Moses and Daniel G Bausch. 2013. “Housing equity for health equity: a rights-based approach to the control of Lassa fever in post-war Sierra Leone”, BMC International Health and Human Rights
- Idris Abdullahi Nasir and Fatima Muhammad Sani. 2015. “Outbreaks, Pathogen Containment and Laboratory Investigations of Lassa fever in Nigeria: How Prepared Are We?”, International Journal of Tropical Disease & Health
- Stefan Kunz, Jillian M. Rojek, Mar Perez, Christina F. Spiropoulou, and Michael B. A. Oldstone. 2005. “Characterization of the Interaction of Lassa Fever Virus with Its Cellular Receptor α-Dystroglycan”, Journal of Virology
- Junjie Shao, Yuying Liang, and Hinh Ly. 2015. “Human Hemorrhagic Fever Causing Arenaviruses: Molecular Mechanisms Contributing to Virus Virulence and Disease Pathogenesis”, Pathogens
- https://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=IT&Expert=99824
- https://www.salute.gov.it/portale/malattieInfettive/dettaglioSchedeMalattieInfettive.jsp?lingua=italiano&id=227&area=Malattie%20infettive&menu=indiceAZ&tab=1
- https://www.msdmanuals.com/it-it/professionale/malattie-infettive/arbovirus-arenaviridae-e-filoviridae/febbre-di-lassa
- https://www.izs.it/BENV_NEW/Engine/RAServePG.php/P/874710010500/M/309910040500/T/LASSA-FEVER-cosa-sta-succedendo-in-Nigeria
- https://www.cell.com/trends/doi/story/10.1016/pic.2015.08.11.2271?startPage=17
- https://www.nih.gov/news-events/news-releases/scientists-develop-novel-vaccine-lassa-fever-rabies
- https://www.cdc.gov/vhf/lassa/index.html
- https://www.viprbrc.org/brc/home.spg?decorator=arena_lassa
- https://www.pasteur.fr/en/research-journal/news/lassa-fever-vaccine-set-be-trialed