Caratteristiche
Burkholderia pseudomallei (precedentemente conosciuta come Pseudomonas pseudomallei e comunemente denominata “bacillo di Whitmore”) è un un batterio di forma bastoncellare, Gram-negativo (Fig. 1), asporigeno, catalasi e ossidasi positivo, aerobio obbligato, mobile mediante dei flagelli polari.
È un batterio saprofita e patogeno che si trova nel suolo, nel fango, nell’acqua e nelle risaie, ed è l’agente eziologico della melioidosi, una patologia infettiva diffusa soprattutto a livello delle latitudini tropicali tra 20° Nord e 20° Sud, che comprendono l’Asia sudorientale (Thailandia, Malaysia, Singapore, Vietnam, Laos, Cambogia, Indonesia, India, Sri Lanka e Taiwan) e l’Australia settentrionale (Fig. 2). Tuttavia, ci sono casi documentati anche in Madagascar e in alcuni stati dell’America centrale e meridionale (Perù, Brasile, Messico, Ecuador, Panama, Puerto Rico, El Salvador).


Il genere Burkholderia deriva dal microbiologo americano Walter H. Burkholder, il quale nel 1950 descrisse il microorganismo responsabile della putrefazione delle cipolle (B. cepacia).
B. pseudomallei è dotata del genoma più ampio e complesso che sia mai stato sequenziato; infatti esso consta di due cromosomi circolari formati da 4.07 e 3.17 megabasi (Mb), che contengono circa 5800 geni il cui contenuto di guanina e citosina arriva al 68%. I geni presenti nel cromosoma più grande codificano per proteine che svolgono funzioni legate alla crescita e al metabolismo cellulare, mentre i loci di quello più piccolo sono associati a ruoli accessori come l’adattamento e la sopravvivenza in ambienti differenti.
È rilevante sottolineare che questo microorganismo, come altri batteri che abitano nel terreno, è difficile da eliminare e riesce a sopravvivere in acqua tri-distillata per anni. In aggiunta a ciò, è tollerante verso il sistema del complemento e alcuni enzimi lisosomiali (tra cui le defensine e i peptidi cationici), produce le emolisine (tossine che lisano i globuli rossi), i siderofori (molecole che legano il ferro) e svariati enzimi come lipasi, perossidasi, superossido dismutasi, proteasi e lecitinasi. Il suo genoma include una grossa mole di fattori di virulenza come adesine, fimbrie, esopolisaccaridi e sistemi di secrezione di tipo III (T3SS, che trasferiscono tossine nelle cellule eucarioti al fine di alterarne l’attività). Oltre a quelli citati, B. pseudomallei sintetizza una “capsula” di glicocalice che genera una mucillagine; questa favorisce la creazione di microcolonie che proteggono il batterio dagli antibiotici.
Filogenesi
Dominio Prokaryota
Regno Bacteria
Phylum Proteobacteria
Classe Betaproteobacteria
Ordine Burkholderiales
Famiglia Burkholderiaceae
Genere Burkholderia
Specie B. pseudomallei
Morfologia delle colonie
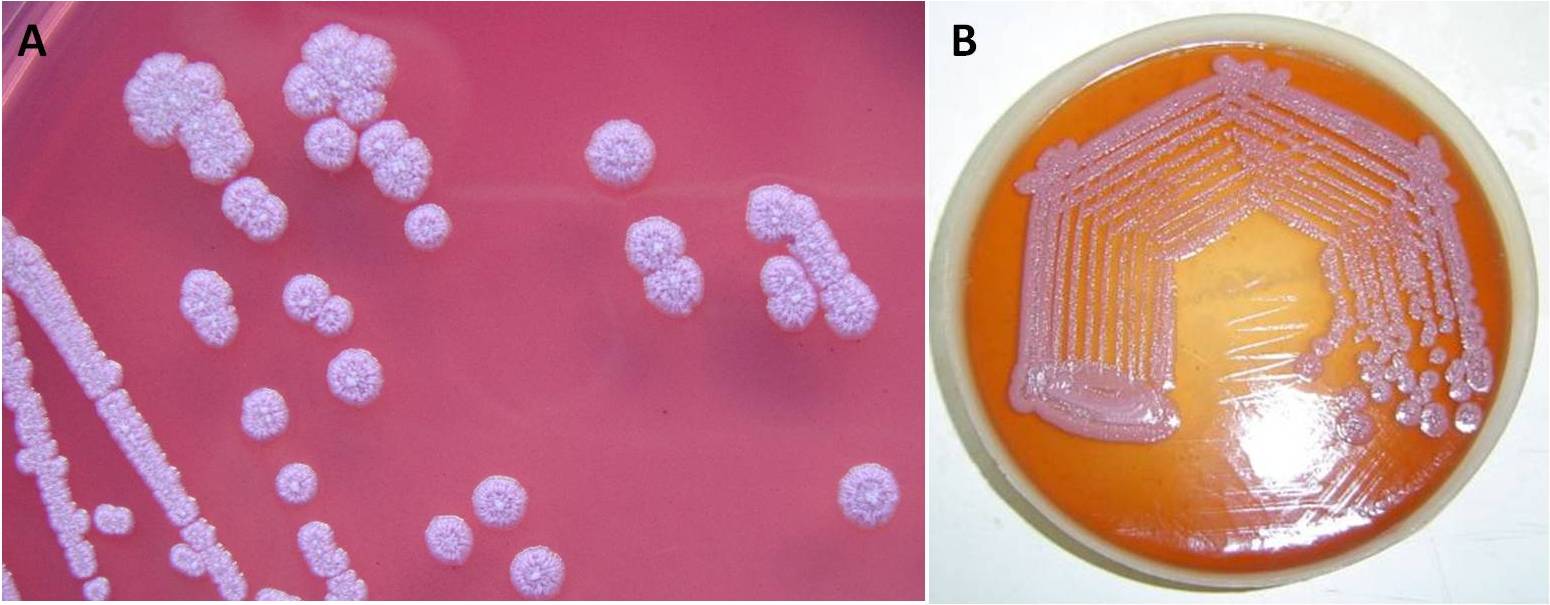
Su agar sangue B. pseudomallei crea delle colonie piccole, dalla superficie liscia, biancastre o color crema nel giro di 48 ore (Fig. 3A). Se si prolunga l’incubazione per tre o cinque giorni, le colonie acquisiscono un aspetto diverso, ossia appaiono disidratate e raggrinzite, ed evocano la testa di un fiordaliso (Fig. 3B). Questa sembianza si può osservare anche su agar Ashdown, un terreno specifico per B. pseudomallei, contenente cristalvioletto e gentamicina come agenti selettivi. In un lasso di tempo di 48 ore si formano delle colonie altamente rugose, circolari e rosa-violacee (Fig. 4A). Se si coltiva il batterio su agar MacConkey, cresceranno delle colonie rosa o incolori, rugose e con una lucentezza metallica (Fig. 4B).

Uno sguardo al processo di invasione
All’inizio abbiamo menzionato i fattori di virulenza del microorganismo, tra cui i sistemi di secrezione di tipo III (T3SS), dei quali discuteremo in maniera più approfondita in questa parte dell’articolo. B. pseudomallei contiene tre gruppi di geni codificanti per i T3SS, e uno di essi (il gruppo TTSS3) presenta un’omologia con due gruppi presenti in altri batteri, ovvero inv/spa/prg TTSS di Salmonella typhimurium e ipa/mxi/spa TTSS della Shigella flexneri. Il TTSS3 codifica per un apparato di secrezione che opera come una siringa molecolare; interagisce con la membrana delle cellule eucariote inoculando delle proteine effettrici nel citoplasma. Questo sistema di secrezione (chiamato bsa) contiene proteine altamente similari a quelle prodotte da S. typhimurium e S. flexneri, che sono essenziali per l’invasione, l’evasione dai vacuoli endocitici, la diffusione intercellulare e la patogenesi.
B. pseudomallei può infiltrarsi in svariati tipi di cellule, comprese quelle epiteliali, e riesce a sopravvivere e a proliferare per lunghi periodi nelle cellule fagocitiche (Fig. 5A). Dopo un lasso di tempo di 15 minuti dalla penetrazione nella cellula bersaglio, il batterio elude i vacuoli endocitici nel citoplasma delle cellule infette tramite la lisi della membrana dell’endosoma (Fig. 5B). In seguito utilizza la proteina BimA per indurre la polimerizzazione dei filamenti di actina, portando alla creazione di protrusioni della membrana e alla diffusione verso altre cellule. Il passaggio da una cellula all’altra avviene quando le cellule fagocitiche limitrofe internalizzano la protrusione, consentendo quindi la propagazione di B. pseudomallei senza l’esposizione agli anticorpi o ad altri processi immunitari dell’organismo ospite. Nella nuova cellula, il microorganismo può fuggire dai vacuoli secondari e moltiplicarsi (Fig. 5C). Un’ulteriore abilità di B. pseudomallei è quella di promuovere la formazione di cellule giganti multinucleate mediante fusione cellulare (Fig. 5D).

Patogenesi
La malattia provocata da B. pseudomallei è la melioidosi (chiamata anche malattia di Whitmore), che colpisce sia gli esseri umani che alcuni animali tra cui pecore, capre, cavalli, maiali, cani e gatti. Il nome della patologia deriva dal greco “melis” (cimurro degli asini) e “eidos” (somiglianza).
Gli organismi suscettibili possono infettarsi attraverso la vicinanza diretta con terra e acqua colonizzate dal microorganismo, quindi mediante inalazione di polvere o gocce d’acqua, ingestione di acqua o cibo contaminati, contatto di ferite e abrasioni con acqua e terriccio contaminati. Il contagio tra individui, al contrario, è un evento decisamente inconsueto.
La melioidosi presenta un ampio assortimento di sintomi che, di solito, compaiono in un periodo da due a quattro settimane dalla prima esposizione. Si distinguono quattro forme di infezione, cioè localizzata, polmonare, setticemica e disseminata. La prima si manifesta con dolore o gonfiore circoscritti, febbre, ulcere e ascessi; la seconda è caratterizzata da tosse, dolore toracico, emicrania, anoressia e febbre alta; nella terza gli individui affetti lamentano febbre, mal di testa, dolore articolare, disorientamento, problemi respiratori e malessere addominale; l’ultima comporta calo ponderale, febbre, emicrania, dolore muscolare o articolare, dolore toracico o gastrico, coinvolgimento del sistema nervoso centrale e convulsioni.
Considerato il numero cospicuo di manifestazioni cliniche, la melioidosi può essere confusa con altre patologie come polmonite o tubercolosi (per tale ragione è soprannominata il “Grande Imitatore”).
Nonostante la malattia di Whitmore possa colpire qualsiasi individuo, anche quelli in perfetta salute, ci sono dei fattori che incrementano il rischio di infezione, tra cui diabete, epatopatie, patologie renali, talassemia (malattia genetica in cui la sintesi dell’emoglobina è alterata), neoplasie e malattie polmonari croniche come fibrosi cistica, bronchiectasia e malattia polmonare ostruttiva cronica.
Finora abbiamo descritto la melioidosi negli esseri umani, adesso illustriamo come appare negli animali sopra citati:
- Nelle pecore possono comparire malattia respiratoria, febbre, tosse grave e fuoriuscita di liquidi dal naso e dagli occhi. Alcune presentano gonfiore articolare e diventano claudicanti;
- Le capre possono accusare sintomi come mastite, ascessi a livello mammellare, debilitazione e andatura zoppicante. La malattia respiratoria è meno seria rispetto alle pecore;
- I maiali manifestano sintomi differenti in base all’età: gli adulti di solito mostrano pochi segni clinici significativi, tuttavia possono sviluppare mancanza di coordinazione, ulcere cutanee, diarrea e deperimento progressivo. Quelli più giovani, invece, sono colpiti da febbre, anoressia, tosse e perdita di liquidi da occhi e naso;
- Per quanto riguarda i cavalli, i sintomi includono debolezza, edema degli arti, coliche leggere, diarrea, tosse, emissione di liquidi dal naso e infezioni cutanee. Queste ultime all’inizio somigliano a eczema fungino, ma in seguito diventano papule;
- Infine, la melioidosi nei cani è distinta da febbre, ascessi epatici, polmonari e testicolari, diarrea grave, dolore muscolare, letargia, tosse e fatica nella respirazione.
Descriviamo ora quattro casi di infezione da B. pseudomallei:
Il primo riguarda un agricoltore di 50 anni, senza alcuna storia di viaggi in paesi stranieri, che lamentava febbre di basso grado, edema bilaterale della caviglia (Fig. 6) e dolore all’ipocondrio sinistro associati ad anoressia, nausea e perdita di peso. All’esame fisico delle caviglie il paziente presentava indolenzimento e restrizione nei movimenti dell’articolazione colpita, mentre all’esame obiettivo ed ecografico dell’addome aveva la milza ingrossata e con multipli ascessi. La radiografia delle caviglie non evidenziò alcun coinvolgimento dell’articolazione, mentre l’ultrasonografia rivelò un accumulo di liquido a livello sottocutaneo.

Gli esami ematochimici rimarcarono neutrofilia (incremento del numero di granulociti neutrofili), aumento della velocità di eritrosedimentazione (VES) e della fosfatasi alcalina (750 U/l). All’uomo venne diagnosticato il diabete mediante il test della tolleranza al glucosio orale e, durante il periodo di ospedalizzazione, sviluppò un gonfiore al ginocchio destro. I medici eseguirono una diagnosi differenziale per sindrome di immunodeficienza acquisita (AIDS), tubercolosi ed endocardite. Tuttavia, egli risultò negativo per tutte e tre le patologie. L’analisi di un aspirato dalla caviglia sinistra segnalò la presenza di pus contenente bacilli Gram-negativi, e la semina del campione su agar sangue e agar MacConkey portò alla crescita rispettivamente di colonie raggrinzite e disidratate e di colonie rugose e rosate. L’aspetto peculiare dei batteri al microscopio e delle colonie incrementarono il sospetto di B. pseudomallei, che venne confermato tramite metodiche biochimiche. Il paziente venne sottoposto a una terapia con ceftazidime, gli ascessi furono curati chirurgicamente, le colture ripetute si negativizzarono, e un mese dopo venne dimesso.
Il secondo è un caso di co-infezione di melioidosi e leishmaniosi, che sono prevalenti nella provincia Centro-Settentrionale, in Sri Lanka. Una donna di 61 anni di Padaviya, con una storia di diabete e ipertensione, giunse al Colombo North Teaching Hospital con febbre, brividi e rigidità che duravano da un mese. Oltre a ciò, aveva sviluppato un ascesso sul braccio sinistro che si era trasformato in un’ulcera (Fig. 7). All’esame fisico dell’addome la paziente presentava un’epatomegalia di 3 cm e una splenomegalia di 18 cm, mentre gli esami cardiovascolare, neurologico e respiratorio non evidenziarono alcuna anomalia. Gli esami ematochimici riscontrarono neutrofilia, valori elevati della proteina C reattiva (149 mg/L) e della VES (122 mm); gli elettroliti, la creatinina e i marcatori epatici, invece, erano normali. I medici eseguirono tre emocolture, di cui la terza risultò positiva per B. pseudomallei in seguito a semina su agar sangue e agar MacConkey. Inoltre, anche il dosaggio degli anticorpi mediante test di emoagglutinazione indiretta era positivo.

L’ecografia e la tomografia computerizzata mostrarono epatosplenomegalia e pancreatite lieve (malgrado i livelli di amilasi sierica fossero normali), ma non rilevarono alcun ascesso addominale.
Dal momento che l’ulcera al braccio non guariva, vennero prelevati dei campioni su cui effettuare l’analisi microscopica, che segnalò la presenza di amastigoti di Leishmania (Fig. 8). L’analisi colturale del tampone da ferita non portò alcuna crescita batterica.

La donna iniziò una terapia intravenosa con ceftazidime, che non ebbe alcun effetto, e sviluppò degli ascessi in tutto il corpo; il pus estratto dagli ascessi, però, non conteneva il batterio. I medici sostituirono il ceftazidime con il meropenem, a cui la paziente rispondeva. Successivamente venne trasferita all’Anuradhapura Teaching Hospital per continuare la terapia con meropenem e passare poi alla terapia orale con trimethoprim e sulfametossazolo. La lesione cutanea venne cauterizzata e l’ulcera guarì quasi completamente al momento delle dimissioni. Nei tre mesi di follow-up la donna non aveva avuto febbre, l’ulcera era guarita del tutto e l’epatosplenomegalia era assente.
Il terzo caso, avvenuto nella provincia di Pattani (nella Thailandia meridionale), ha come protagonista un cane di dieci anni che era rimasto incastrato in un filo spinato durante la notte. Quando lo trovarono, la mattina, aveva delle grandi ferite al collo e sulla schiena e venne immediatamente portato alla clinica veterinaria, dove fu sottoposto a un primo trattamento con amoxicillina/acido clavulanico e carprofene. Quattro giorni dopo le ferite peggiorarono e rilasciarono un essudato purulento, ragion per cui i dottori attuarono un’ulteriore terapia antibiotica con metronidazolo. Le analisi del sangue mostrarono leucocitosi (22.400 cellule/mL) e piastrinopenia (33 x 109 PLTs/L). Poiché dopo sette giorni di trattamento le ferite continuarono ad ampliarsi, il cane venne portato al PSU Animal Hospital, al fine di ottenere una corretta diagnosi di laboratorio e mettere in atto una terapia appropriata. All’esame fisico l’animale aveva una temperatura corporea alta (102,8° F), pallore delle mucose orali e grave fuoriuscita siero-purulenta intorno alle ferite cervicali. Il profilo ematochimico segnalò alti livelli di leucociti (35.940 cellule/mm³), anemia severa (ematocrito di 14,1%), trombocitopenia critica (22×109 PLTs/L), lieve aumento della fosfatasi alcalina (192 U/L) e positività per anticorpi contro due comuni batteri patogeni, cioè Ehrlichia canis e Anaplasma platys.
A questo punto i veterinari iniziarono un trattamento con enrofloxacina in attesa dei risultati delle emocolture, della coltura dei tamponi da ferita e delle analisi del sangue. I globuli bianchi e gli enzimi epatici si erano alzati ulteriormente, e la trombocitopenia persisteva. La coltura dei tamponi da ferita rivelò la presenza di Proteus mirabilis, Pseudomonas aeruginosa ed Escherichia coli, che erano resistenti agli antibiotici somministrati in precedenza, mentre le emocolture risultarono positive alla B. pseudomallei. I risultati ottenuti indussero un cambio della terapia con meropenem e sulfametossazolo-trimethoprim, che consentirono di eliminare il batterio e garantire la guarigione.
L’ultimo caso concerne il decesso di dieci capre provenienti da sei fattorie diverse localizzate in due distretti di Bangkok, in Thailandia. Prima di morire, esse manifestavano polmonite, fiacchezza, anoressia, segni neurologici, mastite e ascessi a diversi organi (fegato, polmoni e milza). Il latte delle femmine risultò positivo al batterio per due volte. L’esame istologico di cuore, fegato, polmoni, milza e rene svelò la presenza di infiammazione granulomatosa, emorragia del miocardio e dell’endocardio, e cellule giganti multinucleate nei polmoni, nei reni e nella milza (Fig. 9).

Metodi di identificazione
Quando ci si trova di fronte a un sospetto diagnostico di melioidosi, l’individuazione del microorganismo si esegue mediante analisi microscopica e colturale su campioni come espettorato, sangue, liquido cerebrospinale, urine o prelievi di lesioni cutanee. I terreni che si adoperano sono l’agar sangue, l’agar MacConkey e l’agar Ashdown. In aggiunta a ciò, si ricorre anche ai metodi sierologici come il test ELISA (saggio immuno-assorbente legato ad un enzima), l’emoagglutinazione (HA) e il test di fissazione del complemento.
Ulteriori approcci diagnostici sono quelli molecolari, che tornano utili quando non si riesce a distinguere B. pseudomallei da altre specie strettamente correlate come B. thailandensis e B. cepacia. Il sequenziamento del gene codificante per la subunità 16S dell’RNA ribosomiale (16S rRNA) permette di differenziare B. pseudomallei da altre specie. Tuttavia, poiché la differenza tra la sequenza genica 16S rRNA di B. pseudomallei e B. thailandensis è minima (1% circa), occorre un gene alternativo per ottenere una maggiore discriminazione tra le due specie, e tale gene è groEL.
Comunque, nel percorso diagnostico della melioidosi è fondamentale effettuare una diagnosi differenziale che comprende tubercolosi, polmonite e altre malattie infettive come febbre tifoide e sifilide.
Terapia e prevenzione
Il trattamento della melioidosi si fonda sull’impiego di antibiotici e normalmente inizia con la somministrazione intravenosa di ceftazidime ogni 6-8 ore oppure meropenem ogni 8 ore, per almeno due settimane. In seguito si passa agli antibiotici orali, tra cui trimethoprim e sulfametoxazolo ogni 12 ore o amoxicillina/acido clavulanico ogni 8 ore, per circa 3-6 mesi.
Per quanto riguarda la profilassi, bisogna ricordare che il batterio si trova nel suolo e nell’acqua, quindi nelle regione endemiche è opportuno evitare il contatto con terriccio e acqua potenzialmente contaminati, soprattutto per le persone che hanno un maggiore rischio di infettarsi.
Fonti
- W. Joost Wiersinga, Tom van der Poll, Nicholas J. White, Nicholas P. Day and Sharon J. Peacock. 2006. “Melioidosis: insights into the pathogenicity of Burkholderia pseudomallei”, Nature
- Allen C. Cheng and Bart J. Currie. 2005. “Melioidosis: Epidemiology, Pathophysiology, and Management”, Clinical Microbiology Reviews
- Rahul Dhodapkar, S Sujatha, K Sivasangeetha, G Prasanth and Subhash Chandra Parija. 2008. “Burkholderia pseudomallei infection in a patient with diabetes presenting with multiple splenic abscesses and abscess in the foot: a case report”, Cases Journal
- Isuru Chamika Indeewara Kahandawaarachchi, Gayani Samadara Premawansa, Wipula Warnasuriya, Malka Dassanayake and Enoka Corea. 2017. “A case report of co-infection of Melioidosis and cutaneous Leishmaniasis”, BMC Infectious Diseases
- Walaiporn Tonpitak, Chulabha Sornklien, Mongkol Chawanit, Suvarin Pavasutthipaisit, Vanaporn Wuthiekanun, Viriya Hantrakun, Premjit Amornchai, Janjira Thaipadungpanit, Nicholas P. J. Day, Samuel Yingst, Sharon J. Peacock, and Direk Limmathurotsakul. 2014. “Short Report: Fatal Melioidosis in Goats in Bangkok, Thailand”, The American Society of Tropical Medicine and Hygiene
- Susanna KP Lau, Siddharth Sridhar, Chi-Chun Ho, Wang-Ngai Chow, Kim-Chung Lee, Ching-Wan Lam, Kwok-Yung Yuen and Patrick CY Woo. 2015. “Laboratory diagnosis of melioidosis: Past, present and future”, Experimental biologt and medicine
- Pacharapong Khrongsee, Chulalak Lueangthuwapranit, Thitsana Ingkasri, Somporn Sretrirutchai, Jedsada Kaewrakmuk, Vannarat Saechan and Apichai Tuanyok. 2019. “Successful Treatments and Management of A Case of Canine Melioidosis”, Veterinary Science
- https://www.clinicacastelli.it/enciclopedia-medica/infezione-da-bukholderia-pseudomallei/
- https://www.cdc.gov/melioidosis/index.html
- https://www.orpha.net/consor/cgi-bin/Disease_Search.php?lng=EN&data_id=9291
- https://www.sciencedirect.com/topics/medicine-and-dentistry/burkholderia-pseudomallei
- https://microbe-canvas.com/Bacteria.php?p=1233
- https://www.the-rheumatologist.org/article/melioidosis-what-rheumatologists-need-to-know/
- https://www.hardydiagnostics.com/wp-content/uploads/2016/05/Burholderia-pseudomallei-Marilyn-Sarina.pdf
- https://microbenotes.com/ashdowns-agar/
- https://www.agric.wa.gov.au/livestock-biosecurity/melioidosis-animals
- https://vcahospitals.com/know-your-pet/melioidosis-in-dogs
Fonti immagini
- https://phil.cdc.gov/Details.aspx?pid=1926
- https://it.wikipedia.org/wiki/Melioidosi
- https://www.cam.ac.uk/research/news/melioidosis-exposing-the-%E2%80%98great-mimicker%E2%80%99
Disponibile episodio Podcast cliccando qui.