Caratteristiche
Blastomyces dermatitidis è un fungo appartenente al phylum degli Ascomiceti e raffigura l’agente eziologico della blastomicosi, una patologia cronica e invasiva descritta per la prima volta nel 1894 dal dermatologo britannico Thomas Caspar Gilchrist (per tale ragione è conosciuta anche come Malattia di Gilchrist). Si tratta di un micete che risiede nel suolo e nei materiali organici come feci, frammenti di piante, legno in putrefazione, residui di insetti e polvere, e prolifera in ambienti umidi, scarsamente illuminati, leggermente acidi (pH 6) e contenenti detriti organici.
Si comporta come un micete dimorfo, ovvero a temperatura ambiente cresce sotto forma di muffa creando un micelio composto da ife ialine, mentre a 37° C (come la temperatura corporea o degli incubatori usati nei laboratori) assume l’aspetto di un lievito.
Il micete è endemico nella parte orientale del Nord America, specialmente nelle aree settentrionale e meridionale rispettivamente di Ontario e Manitoba (province canadesi), in alcune parti dei monti Appalachi e nelle catene montuose orientali interconnesse, nella sponda occidentale del lago Michigan, nelle valli del Missouri, negli stati di New York, Ohio, South Carolina, North Carolina, Louisiana, Mississippi e Wisconsin.
Comunque, dei casi di blastomicosi hanno luogo anche in Africa, a nord e sud del Sahara, come anche nella penisola Araba e nel subcontinente Indiano.

Filogenesi
Dominio Eukaryota
Regno Fungi
Phylum Ascomycota
Classe Eurotiomycetes
Ordine Onygenales
Famiglia Onygenaceae
Genere Blastomyces
Specie B. dermatitidis
Morfologia delle colonie
Come abbiamo descritto nella prima parte, B. dermatitidis si sviluppa in due modi differenti a seconda della temperatura, ossia muffa o lievito.
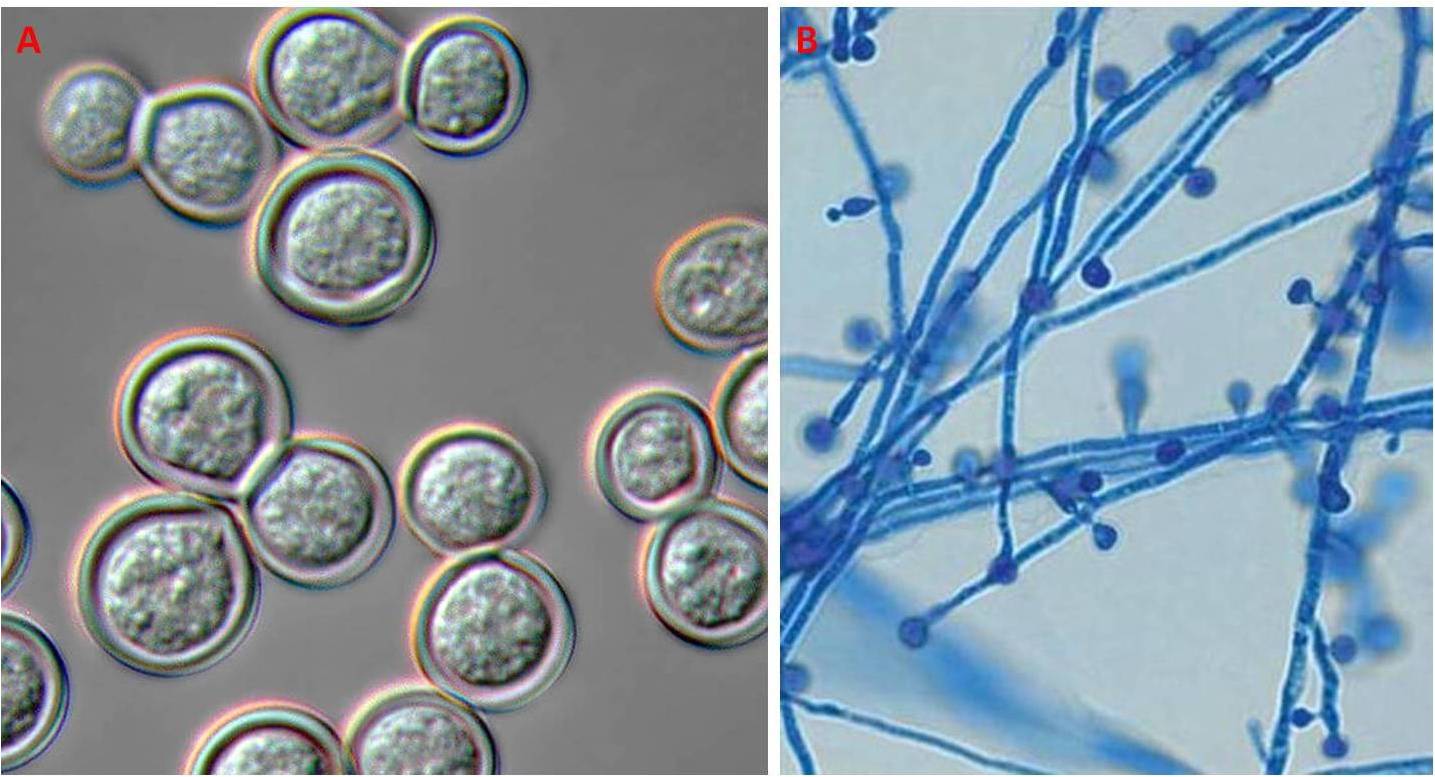
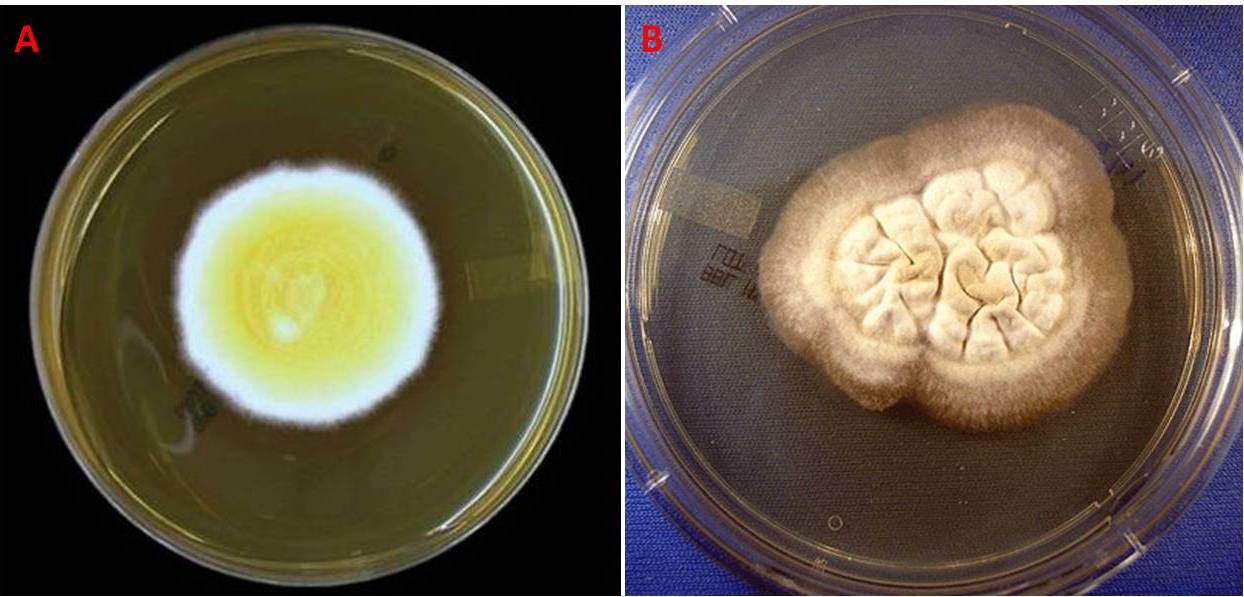
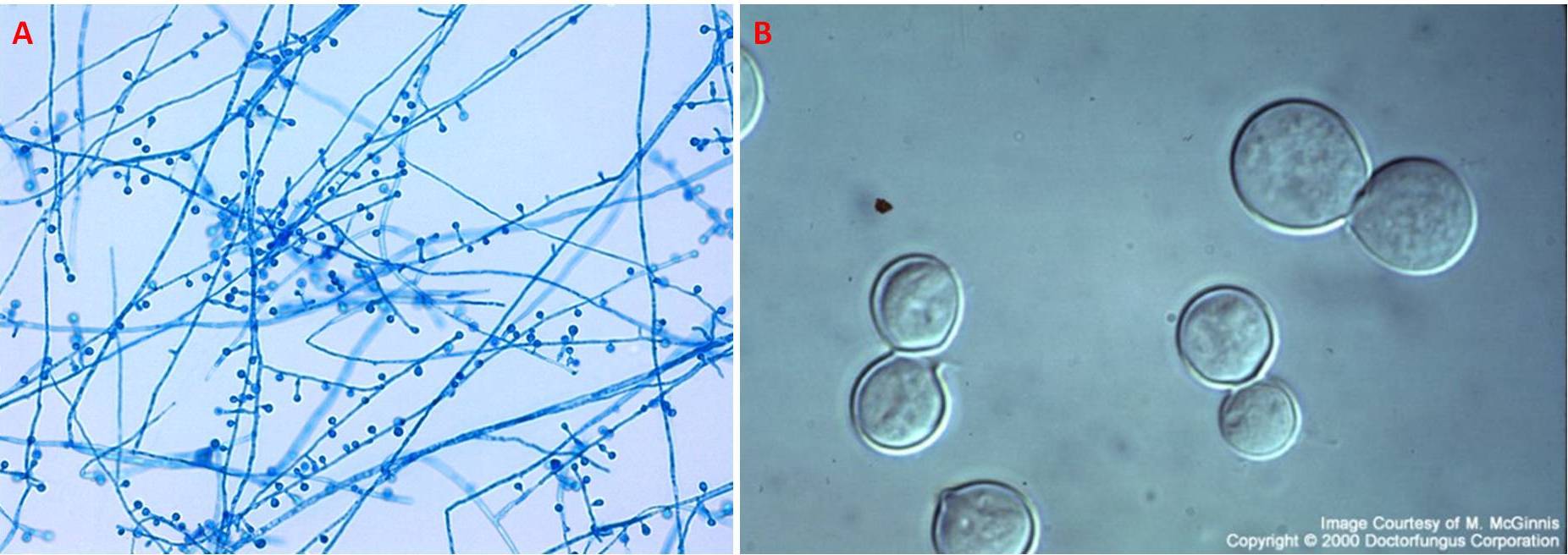
Su Sabouraud Dextrose Agar, a temperatura ambiente, il fungo può germogliare rapidamente creando delle colonie dall’aspetto soffice, bianche o tendenti al marrone (Fig. 3A), oppure lentamente generando delle colonie glabre e marroni chiaro (Fig. 3B). Microscopicamente il microorganismo è caratterizzato da ife settate e ramificate che sorreggono le spore asessuate dette conidi o clamidospore; queste sono collocate a livello dei conidiofori terminali o laterali, e sono distinte da un aspetto ialino e una forma sferica, ovoidale o piriforme (Fig. 4A). Le dimensioni vanno da 3 a 5 μm di diametro, anche se in alcuni casi il micete arriva a produrre spore di maggiore grandezza (7-18 μm).
Quando cresce come lievito, B. dermatitidis si presenta, al livello microscopico, con una conformazione sferica, è multinucleato e dotato di una parete dallo spessore di 8-15 μm; la riproduzione avviene per gemmazione, in cui la cellula primaria dà origine a delle singole cellule, che rimangono connesse alla cellula madre mediante una parete persistente e un largo poro (4-5 μm). Sovente la cellula figlia si ingrandisce acquisendo le stesse dimensioni della cellula madre prima di staccarsi. Le colonie appaiono rugose e pallide (Fig. 4B).
Patogenesi
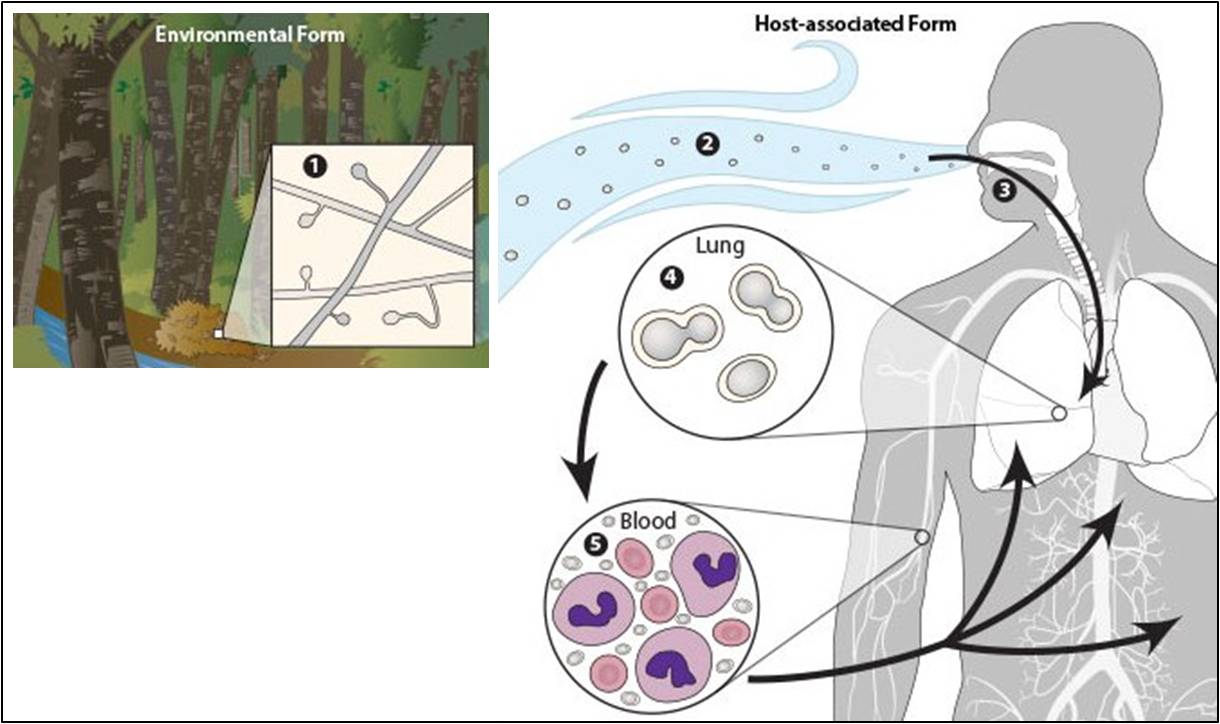
L’infezione da B. dermatitidis si instaura a partire dal contatto con le spore fungine rilasciate nell’ambiente. Queste, contenute nel terreno o nella materia organica in decomposizione, vengono inalate e raggiungono i polmoni (Fig. 5); più raramente contaminano le ferite aperte. Nel primo caso si verifica la blastomicosi polmonare, che è la forma più frequente; nel momento in cui i conidi arrivano fino agli alveoli, i macrofagi alveolari, i granulociti neutrofili e i monociti provvedono a difendere l’organismo dall’infezione fagocitando e uccidendo le spore. Ciononostante, i conidi possono riuscire a sopravvivere alla fagocitosi e germinare in lievito.
In assenza di una terapia appropriata o se il sistema immunitario non è in grado di contenere l’infezione, avviene la disseminazione lungo i circoli linfatico ed ematico, con conseguente coinvolgimento di altri organi come la cute, le ossa, il tratto genitourinario e il sistema nervoso centrale. La risposta tissutale al micete è caratterizzata da una combinazione di suppurazione e reazione granulomatosa in cui sono implicate cellule epitelioidi, e può variare da individuo a individuo o da sito a sito nella stessa persona. Contrariamente alla risposta immunitaria cellulo-mediata, che riesce a prevenire la progressione della blastomicosi, quella mediata da anticorpi non ha alcun ruolo significativo nella protezione dell’organismo verso il patogeno.
La forma polmonare della blastomicosi comincia con una lieve infezione respiratoria che progredisce verso lo sviluppo di sintomi come tosse secca, dolore pleurico, raucedine (alterazione della voce che diventa aspra e stridula o bassa e cavernosa) e febbre di basso grado. Nel giro di giorni o mesi, a causa della diffusione e la suppurazione delle lesioni mediastiniche e parenchimali originarie, si ha un incremento dell’espettorato, che si presenta purulento ed ematico, comparsa di dispnea, calo ponderale, fiacchezza, sudorazione notturna, brividi e febbre alta. In alcune circostanze insorge il versamento pleurico, e alcuni individui manifestano una sindrome da insufficienza respiratoria acuta. Poiché il processo infiammatorio con granulomi e aree suppurative è spesso di lunga durata, può sfociare in fibrosi.
Nel momento in cui il microorganismo invade altri distretti del corpo, la blastomicosi evolve verso la forma disseminata, che coinvolge la cute, la mucosa oronasale, i tessuti sottocutanei, i sistemi osseo, urogenitale e nervoso centrale.
Partendo dalla blastomicosi del tessuto osseo, bisogna sottolineare che i danni alle ossa comportano dolore e perdita di funzione che possono progredire in osteomielite, periostite e, saltuariamente, in artrite settica. Le ossa colpite con maggiore assiduità sono le ossa lunghe, le vertebre, il cranio e le costole.
La blastomicosi del sistema nervoso riguarda una percentuale del 6%-33% dei casi di blastomicosi disseminata, ed è distinta da ascessi cerebrali, craniali o epidurali, e meningite; i sintomi sono emicrania, difetti neurologici focali, confusione e disturbi visivi. In aggiunta a ciò, possono esserci complicazioni come idrocefalo, ernia e infarto cerebrali, perdita della funzione ipofisaria, debolezza e riduzione delle capacità di studio e apprendimento. Nei pazienti con meningite il liquido cerebrospinale risulta colmo di linfociti e neutrofili, con elevata quantità di proteine e scarso glucosio. Non è insolito che nelle persone affette da questa malattia venga individuata una massa nel parenchima cerebrale che può essere confusa con un tumore (blastomicoma).
Nella diffusione all’apparato urogenitale gli organi colpiti negli uomini sono la prostata, l’epididimo e i testicoli, con comparsa di gonfiore scrotale, ingrandimento testicolare, disuria (difficoltà nell’emissione di urina) e piuria (pus nelle urine). Nelle donne induce ascesso tubo-ovarico, endometrite e salpingite (infiammazione delle tube di Falloppio); la malattia si può complicare in seguito alla propagazione al peritoneo e all’omento, con o senza ascite.
Può capitare che anche i reni siano coinvolti, e in tal caso i pazienti accusano i sintomi della pielonefrite come malessere, nausea, minzione dolorosa, ematuria, febbre e dolore lombare; l’infezione può condurre ad ascessi renali ed estendersi oltre la capsula provocando ascessi perinefrici.
Nelle poche circostanze in cui la disseminazione del micete è particolarmente ampia, si formano granulomi e ascessi al fegato e alla milza.
Per quanto concerne la blastomicosi cutanea, è opportuno rimarcare che la cute raffigura il sito d’infezione extrapolmonare più comune, il cui interessamento succede nel 40-80% degli episodi di blastomicosi disseminata. All’inizio la malattia insorge sotto forma di nodulo sottocutaneo, papula o pustola (Fig. 6A e 6B) che va incontro a ulcerazione. La maggior parte delle lesioni cutanee sono il risultato della spargimento ematogeno del fungo a partire da una lesione polmonare o viscerale a un’area sottocutanea o cutanea; inoltre, esse compaiono specialmente nelle zone del corpo più esposte all’aria, come la testa e le estremità. Nel giro di settimane o mesi si trasformano in granulomi ulcerati o verrucosi con bordi serpiginosi aventi una sporgenza di 1-3 mm e un’area centrale coperta di croste (Fig. 6C e 6D). La base delle lesioni è granulomatosa e contiene un’elevata quantità di piccoli ascessi, mentre i bordi in rilievo sono induriti, rossi scuro o violacei, e anch’essi comprendono numerosi piccoli ascessi.

Le lesioni si diffondono lentamente, e in un periodo di qualche mese o anno si estendono anche sul viso spesso deformandone i lineamenti e lasciando una sottile cicatrice atrofica lungo l’area centrale della lesione vecchia.
La blastomicosi è considerata un aggravamento della sindrome di immunodeficienza acquisita (AIDS) avanzata, e colpisce soprattutto coloro che hanno un numero ridotto di linfociti CD4 (<200 cellule/mm³). Tuttavia, si può osservare anche negli individui in chemioterapia o in terapia con corticosteroidi, e negli individui che hanno subito un trapianto d’organo. È rara nelle donne incinte, anche se è stata documentata la trasmissione verticale al neonato; tale evento non incrementa il rischio di malformazioni congenite, ma in casi sporadici è responsabile della blastomicosi polmonare neonatale, che può risultare fatale. Anche nei bambini la patologia è inconsueta, però le manifestazioni cliniche sono simili a quelle degli adulti immunodepressi.
Fattori di virulenza
Nel momento in cui i conidi o i frammenti miceliali inalati giungono ai polmoni, la temperatura dell’organismo ospite induce la conversione in lievito patogeno. I conidi che vengono fagocitati dai macrofagi alveolari sono in grado di sopravvivere e di effettuare il cambiamento a lievito, e tale capacità è comune ad altri funghi dimorfi come Histoplasma capsulatum, Coccidioides spp. e Paracoccidioides spp. Nella fase di transizione da spora a lievito sono implicati svariati geni, inclusi DRK-1 (dimorphism-regulating kinase-1) e BAD-1 (Blastomyces adhesion-1); il primo codifica per un’istidina chinasi che gioca un ruolo essenziale nella modificazione dei conidi in lievito, mentre il secondo codifica per una proteina che facilita l’adesione e l’evasione dalla risposta immunitaria. Se DRK-1 è deleto, il fungo cresce come muffa anche a 37° C e non esprime BAD-1.
La proteina BAD-1 viene prodotta dal lievito nell’ambiente extracellulare e si lega alla superficie cellulare mediante l’interazione con la chitina contenuta nella parete delle cellule fungine. BAD-1 permette l’evasione dall’azione del sistema immunitario sopprimendo il rilascio del fattore di necrosi tumorale alfa (TNF-α), una citochina fondamentale per la difesa dell’organismo dal micete. Peraltro, inibisce l’attivazione dei linfociti T CD4. Si è constatato che i ceppi di B. dermatitidis mutanti per BAD-1 (BAD-1Δ) sono avirulenti, e che i topi infettati con ceppi BAD-1Δ presentano dei polmoni normali e con pochi granulomi.
In aggiunta alla secrezione di BAD-1, durante il processo di transizione avviene la modifica della composizione di carboidrati della parete cellulare del micete, che può contribuire alla virulenza. La quantità di alfa-(1,3)-glucano aumenta, mentre diminuisce la concentrazione di beta-(1,3)-glucano. Studi precedenti su Paracoccidioides brasiliensis e Histoplasma capsulatum hanno rivelato che la perdita di alfa-(1,3)-glucano attenua la virulenza. Non si conosce bene la funzione di questo polimero nella virulenza di B. dermatitidis e di altri funghi dimorfi, ma è stata formulata l’ipotesi secondo cui tale polimero possa mascherare altre componenti della parete cellulare come l’adesina WI-1. Questa molecola rappresenta uno dei principali antigeni bersaglio delle risposte immunitarie cellulari e umorali, e media l’adesione e l’entrata del lievito nei macrofagi (due proteine di membrana dei macrofagi, CR3 e CD14, sono stati identificati come i recettori cellulari per WI-1). Esperimenti di clonaggio hanno mostrato che WI-1 esibisce un’alta omologia di sequenza con l’invasina (un’adesina e fattore di virulenza dei batteri del genere Yersinia).
Metodi di identificazione
L’approccio diagnostico della blastomicosi consta di multiple analisi, iniziando con l’esame fisico e le indagini radiografiche, che però non sono specifiche. Per esempio nella blastomicosi polmonare le analisi radiografiche possono mimare polmoniti batteriche, tubercolosi o tumori maligni. Le anormalità che risultano dalle radiografie possono includere consolidamento parenchimale, masse nodulari, patologie del flusso aereo (broncopneumopatia), malattie interstiziali e lesioni cavitarie (Fig. 7).
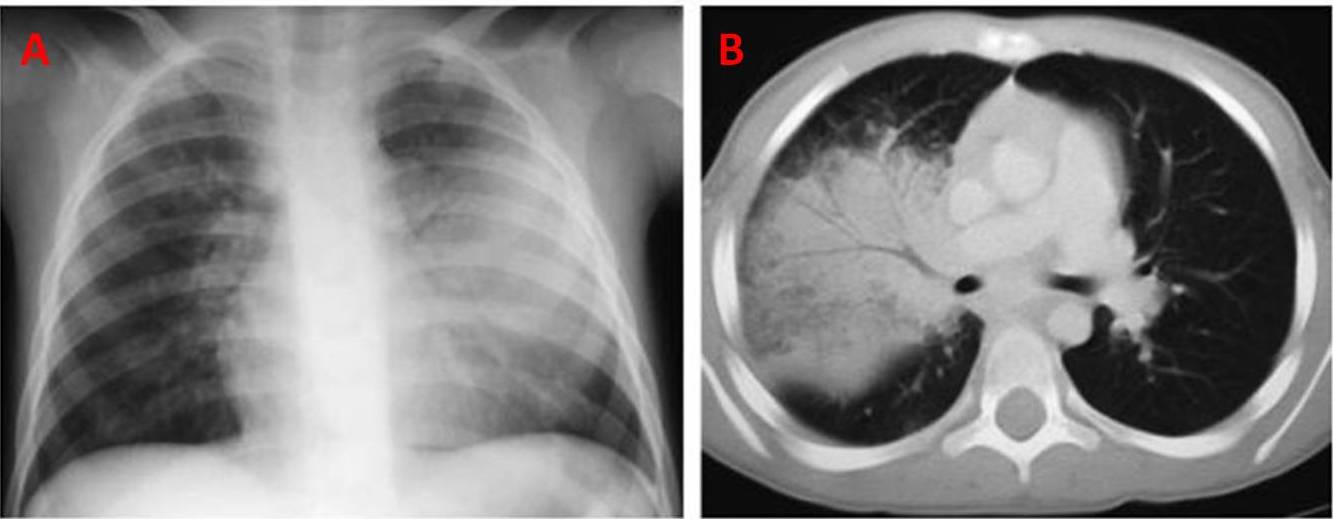
Ciò che facilita la diagnosi è una storia dettagliata che permetta di identificare le potenziali esposizioni e gli individui a rischio; nei pazienti con polmonite i medici dovrebbero raccogliere informazioni riguardanti il luogo di residenza, i viaggi, le attività all’aperto, gli hobby, le recenti ristrutturazioni della casa, il contatto con aree di costruzione delle strade e l’utilizzo di forni a legna
Nell’accertamento di una possibile infezione da B. dermatitidis sono necessarie le analisi di laboratorio, tra cui l’esame diretto, l’esame colturale e la sierologia. Il primo consiste nel prelevare uno specifico campione, diverso a seconda del tipo di malattia, mescolarlo con idrossido di potassio e osservarlo al microscopio; per la blastomicosi cutanea si raccoglie del pus proveniente dagli ascessi delle lesioni cutanee, mentre per quella polmonare si impiega l’espettorato (che deve essere raccolto lontano dai pasti e dopo il lavaggio dei denti), selezionando le porzioni con tracce di pus e sangue. Dato che le cellule del micete sono grandi ed evidenti, la colorazione non è necessaria. Anzi, l’individuazione della peculiare forma del lievito, con le due cellule attaccate tra loro mediante la parete, può condurre a una presunta diagnosi di blastomicosi prima che i risultati degli esami colturali e non siano disponibili.
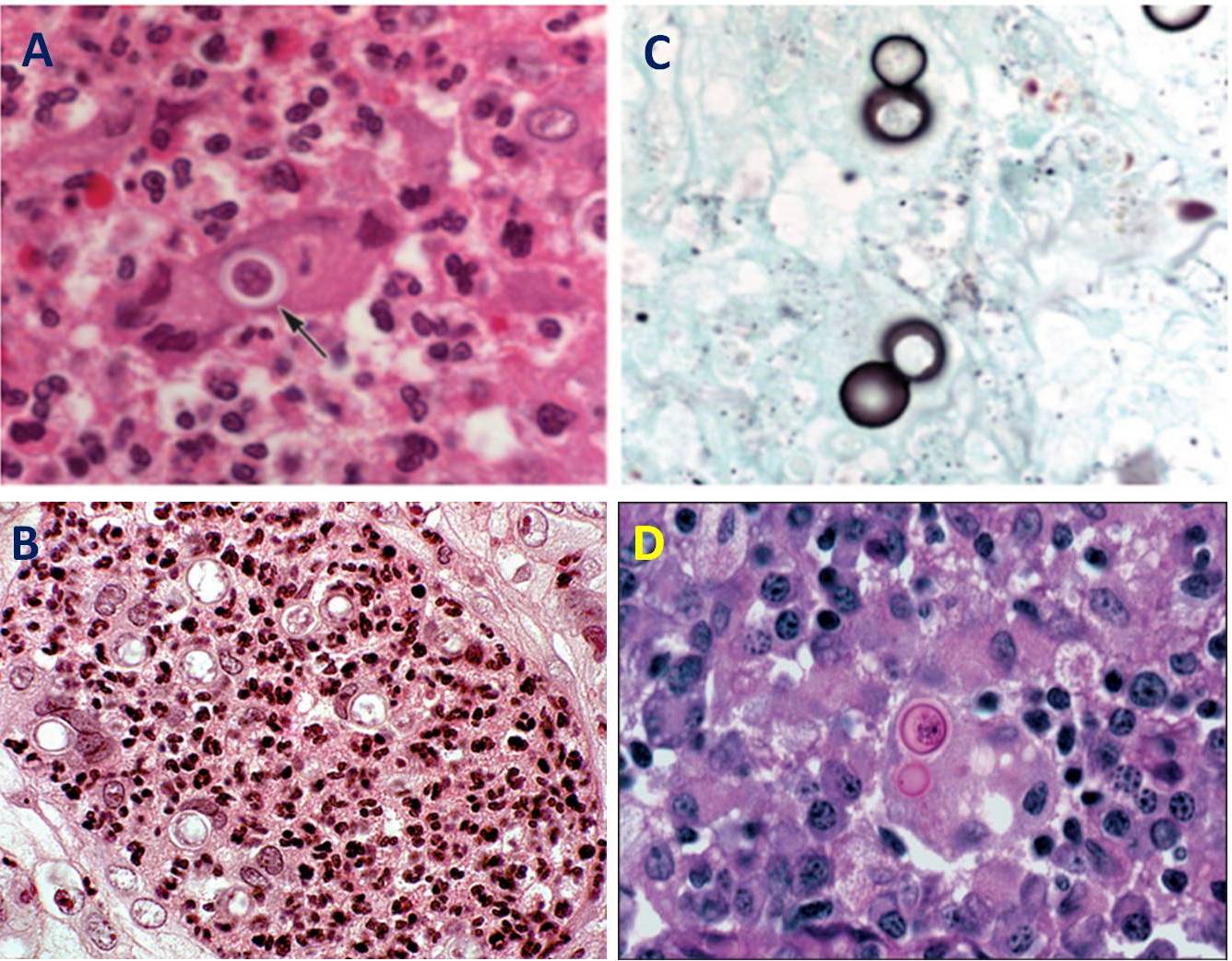
È utile anche l’esame istologico su una biopsia applicando alla sezione di tessuto diverse colorazioni: Ematossilina-Eosina per distinguere i leucociti polimorfonucleati e la reazione granulomatosa dovuta alle interazione dei neutrofili con i tessuti (Fig. 8A e 8B), la reazione PAS (acido periodico – reattivo di Schiff) e la colorazione di Grocott-Gomori (GMS) per scorgere il fungo. Con la reazione PAS le cellule si colorano di un pigmento rossastro su uno sfondo rosa-violetto (Fig. 8D), mentre con la metodica GMS appaiono con una parete nera e l’interno chiaro su uno sfondo verdastro-celestino (Fig. 8C).
Per quanto concerne l’esame colturale, gli stessi campioni come pus da lesioni ulcerative cutanee, espettorato, secrezione tracheale vengono seminati su terreni come Sabouraud Dextrose Agar e Potato Dextrose Agar, che devono essere incubati a temperature di 25-30°C, al fine di permettere la crescita del micete sotto forma di muffa. Malgrado la metodica sia altamente specifica, presenta l’inconveniente dei tempi lunghi di incubazione che vanno da 5 a 14 giorni.
Per concludere questa parte, descriviamo i test sierologici per ricercare gli anticorpi contro il micete; tra questi abbiamo il test di fissazione del complemento (CF) e l’immunodiffusione (ID), che però non sono molto efficaci ai fini diagnostici, in quanto la sensibilità e la specificità sono basse. Al contrario, il test immunoenzimatico su pozzetti adsorbiti con BAD-1 possiede una sensibilità e una specificità rispettivamente di 87% e 94-99%; giacché BAD-1 è espresso solo da Blastomyces, questo saggio permette di distinguere tra la blastomicosi e l’istoplasmosi. Un test antigenico che rileva il galattomannano della parete cellulare di Blastomyces ha integrato il CF e l’ID, e si può adoperare su campioni di urina, siero, bronco-lavaggio alveolare e liquido cerebrospinale. La sensibilità dell’antigenuria (antigene nelle urine) nei pazienti con malattia comprovata è 76,3-92,9% e la specificità è 79,3%.
Terapia
I farmaci maggiormente utilizzati per il trattamento della blastomicosi sono l’Amfotericina B (AmB) e i Triazoli (o antimicotici azolici). Prima di iniziare il trattamento, bisognerebbe valutare i parametri ematologici, epatici e renali. Inoltre, è necessario effettuare un controllo accurato dei vari medicinali di cui un paziente fa uso, al fine di limitare le interazioni farmacologiche di solito connesse con gli antimicotici azolici (Itraconazolo, Chetoconazolo, Fluconazolo). Questi, quando somministrati insieme ad altri farmaci, possono prolungare l’intervallo QT nell’elettrocardiogramma. In aggiunta a ciò, incrementano i livelli di inibitori dell’enzima idrossimetilglutaril-Coezima A reduttasi (statine), che sono metabolizzati dal citocromo P450 3A4, e ciò aumenta il rischio di rabdomiolisi indotta da statine. Tale evento non avviene con la Pravastatina, in quanto non metabolizzata dal P450 3A4, e quindi può essere somministrata insieme ai Triazoli.
L’AmB è raccomandata in caso di infezione polmonare grave, malattia disseminata, coinvolgimento del sistema nervoso centrale e immunosoppressione; tra l’altro, è il farmaco di prima linea per neonati e donne in gravidanza. Il meccanismo d’azione dell’AmB consiste nell’inserirsi nella membrana cellulare dei funghi alterandone la permeabilità; questo comporta la perdita di ioni e piccole molecole organiche, con conseguente morte cellulare. Nonostante l’efficacia dimostrata, l’impiego dell’AmB è associato a significativa tossicità, in particolare nefrotossicità, che colpisce più del 30% delle persone trattate. Altri effetti avversi sono ipossia, nausea, vomito, ipertensione, febbre, ipokaliemia e ipomagnesemia.
Per quanto riguarda la terapia con i Triazoli, l’Itraconazolo raffigura il farmaco di prima linea per la blastomicosi lieve o moderata, in cui il sistema nervoso centrale non è coinvolto. Esso agisce inibendo l’enzima 14-alfa-demetilasi, importante per la sintesi di ergosterolo, e può essere prescritto in soluzione (somministrazione endovenosa) o in capsule (somministrazione orale). Non è consigliato durante la gravidanza e l’allattamento.
Nel caso in cui ci siano grandi ascessi polmonari che richiedono il drenaggio, si ricorre alla chirurgia insieme alla terapia antimicotica.
Fonti
- Brook Watts, Pushkar Argekar, Sanjay Saint and Carol A. Kauffman .2007. “Clinical problem-solving. Building a diagnosis from the ground up–a 49-year-old man came to the clinic with a 1-week history of suprapubic pain and fever”, The New England Journal of Medicine
- Chester W. Emmons, Chapman H. Binford, John P. Utz e K. J. Kwon-Chung. 1977. “Medical Micology”, Lea & Febiger
- Joseph A. McBride, Gregory M. Gauthier and Bruce S. Klein. 2017. “Clinical manifestations and treatment of blastomycosis”, Clin Chest Med
- Bruce S Klein. 2000. “Molecular basis of pathogenicity in Blastomyces dermatitidis: the importance of adhesion”, Current Opinion in Microbiology
- Wayne Fang, Lacey Washington and Nidhi Kumar. 2007. “Imaging Manifestations of Blastomycosis: A Pulmonary Infection with Potential Dissemination”, RadioGraphics