Caratteristiche
Histoplasma capsulatum (Fig. 1) è un fungo appartenente al phylum degli Ascomiceti, strettamente correlato con Blastomyces dermatitidis, si trova nel suolo e negli escrementi di volatili come storni, merli e pipistrelli, ed è responsabile della patologia detta istoplasmosi (o Malattia di Darling). È un fungo dimorfo, ovvero può mutare la sua forma di crescita da muffa a lievito e viceversa; nell’ambiente prolifera creando una struttura filamentosa, mentre all’interno degli organismi a sangue caldo si converte in lievito germogliante.

La prima descrizione di questo micete risale al 1905-1906 da parte del patologo e batteriologo americano Samuel Taylor Darling, il quale identificò un microorganismo simile a un protozoo durante un’autopsia su un carpentiere di 27 anni che stava lavorando alla costruzione del Canale di Panama. Darling collegò le sue scoperte a ciò che era stato osservato nelle infezioni da protozoi e coniò il termine Histoplasma capsulatum per le seguenti caratteristiche: tale microorganismo invadeva il citoplasma (“plasma”) di cellule somiglianti agli istiociti (“histo”), e presentava un alone che evocava una capsula (“capsulatum”). Nel 1912, il patologo e infettivologo brasiliano Henrique da Rocha-Lima riconobbe il microorganismo come un fungo e ne fornì una corretta descrizione. Da quel momento Histoplasma venne diviso, a livello tassonomico, in tre gruppi in base alla distribuzione geografica: H. capsulatum var. capsulatum, che è il più diffuso nel mondo, H. capsulatum var. duboisii, prevalente in Africa, e H. capsulatum var. farciminosum, conosciuto come un patogeno dei cavalli. Allo scopo di affinare le classificazioni filogenetiche, nel 2003 un gruppo di ricercatori guidati da Takao Kasuga studiarono le relazioni filogenetiche di 137 isolati del micete raffiguranti le tre suddivisioni originali di Histoplasma. Impiegando la variazione della sequenza del DNA in quattro geni indipendenti, codificanti per proteine, essi identificarono otto cladi; sette di queste erano gruppi geneticamente isolati, riconosciuti come specie aventi relazioni filogenetiche. Al giorno d’oggi la ripartizione di Kasuga viene usata al fine di distinguere i funghi del genere Histoplasma.
Epidemiologia
La distribuzione epidemiologica di H. capsulatum abbraccia pressappoco l’intero globo, comprese Asia, Africa, Australia, America Centrale, Meridionale e Settentrionale. In quest’ultima un’alta incidenza è stata documentata in Ohio e nelle valli del Mississippi, mentre nell’America del Sud c’è una preponderanza in Brasile, Venezuela, Ecuador, Paraguay, Uruguay e Argentina. Una potenziale causa di tale distribuzione può essere associata alle caratteristiche del suolo e le differenze climatiche. Comunque, l’istoplasmosi rappresenta l’infezione fungina con maggiore incidenza negli Stati Uniti; oltre ai due luoghi sopra citati, alcuni studi attestano diversi casi di istoplasmosi in aree che prima non erano considerate endemiche, tra cui California, Arizona, Idaho, Montana e New York, come anche Michigan, Minnesota e Wisconsin. In aggiunta a ciò, in New Mexico, Colorado e Alaska si sono verificati dei casi negli animali come lontre di mare e gatti. In Canada l’istoplasmosi è endemica in Quebec e Ontario.
Per quanto concerne l’Africa, gli episodi di istoplasmosi avvengono soprattutto nella parte occidentale (specie in Nigeria), nella Repubblica Democratica del Congo, in Uganda, in Tanzania e in alcune zone sparse dell’Africa centrale ed orientale, inclusi degli eventi isolati in Madagascar.
La figura 2 riassume la collocazione nel mondo di H. capsulatum.

Filogenesi
Dominio Eukaryota
Regno Fungi
Phylum Ascomycota
Classe Eurotiomycetes
Ordine Onygenales
Famiglia Ajellomycetaceae
Genere Histoplasma
Specie H. capsulatum
Morfologia delle colonie
Come abbiamo accennato nella parte iniziale, H. capsulatum è un fungo dimorfo, ossia acquisisce sembianze dissimili in base alla temperatura a cui germina. A 25° C esibisce l’aspetto di una muffa caratterizzata da ife ialine e settate, con i conidiofori che si elevano a destra delle ife primarie. Dai conidiofori vengono rilasciati sia macroconidi che microconidi; i primi sono tubercolati, dotati di una parete spessa, rotondi, ialini, grandi e sovente possiedono delle proiezioni sulla superficie, simili a delle dita (Fig. 3A). I secondi, invece, sono ialini, sferici, con una parete liscia o ruvida (Fig. 3B).
A 37° C il micete cresce sotto forma di lievito, le cui cellule sono ovoidali o tondeggianti, di un colore violaceo intenso e circondate da un alone chiaro (Fig. 3C e 3D). Le dimensioni variano a seconda del gruppo: 2-5 μm per H. capsulatum var. capsulatum, 8-15 o 4-6 μm per H. capsulatum var. duboisii.

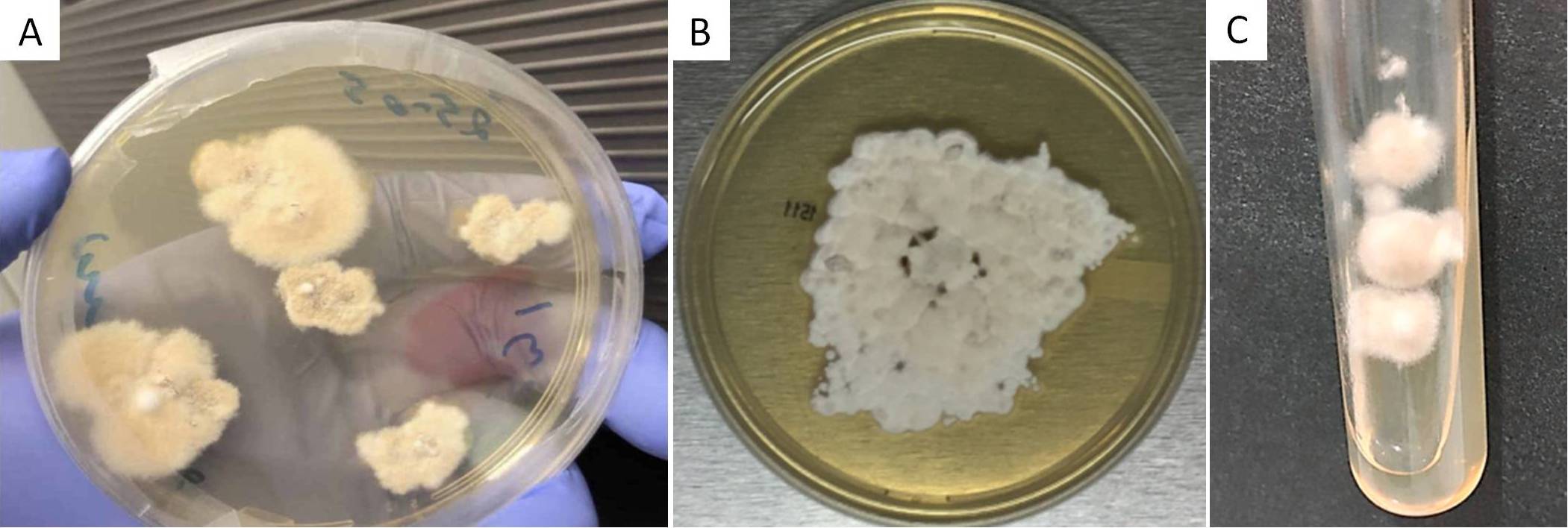
Dal punto di vista macroscopico, a 25° C il micete crea delle colonie che appaiono granulose o cotonose, bianche all’inizio per poi virare al color camoscio. Se si volta la piastra, è possibile apprezzare un pigmento giallastro o giallastro-arancio. Queste caratteristiche sono facilmente osservabili su Sabouraud Dextrose Agar (SDA) (Fig. 4A), su Potato Dextrose Agar (PDA) (Fig. 4B) e su Mycosel Agar (Fig. 4C).
Se si coltiva il fungo a 37° C, esso prolifera lentamente creando delle colonie dall’aspetto umido e paragonabili a un lievito.
Patogenesi
L’istoplasmosi è una micosi profonda e spesso cronica dei polmoni e del sistema reticolo-endoteliale che coinvolge i tessuti linfatici, la milza, il fegato, i reni, le ghiandole surrenali, la cute, il sistema nervoso centrale e altri organi. In gran parte dei casi la malattia risulta asintomatica o con sintomi talmente leggeri che la persona colpita non consulta un medico. Ciò che condiziona la gravità dei sintomi e il quadro clinico sono la capacità del fungo di evadere la risposta infiammatoria e l’intensità delle difese immunitarie dell’ospite.
L’infezione si verifica in seguito all’inalazione dei microconidi del micete (o dei frammenti di ife) che viaggiano lungo il canale respiratorio fino ad arrivare agli alveoli. In questa zona le spore si convertono in lievito, e tale processo può avere luogo all’interno o all’esterno dei macrofagi, che fagocitano il microorganismo (Fig. 5). Queste cellule rappresentano i veicoli per la diffusione del patogeno ai linfonodi e ai vari organi.

Inizialmente l’infezione è localizzata ai polmoni e di solito perdura in questa zona, dove può entrare in uno stato di latenza grazie alla formazione di granulomi (sfortunatamente non è stato possibile reperire immagini al microscopio di granulomi polmonari, però le due foto di granulomi epatici della figura 6 aiutano i lettori ad avere una visione di come sono fatti i granulomi indotti dall’H. capsulatum). Tuttavia, se le difese immunitarie non riescono a contenere l’infezione, l’agente patogeno si espande verso altre sedi mediante il flusso ematico.

Esistono tre forme primarie di istoplasmosi:
- Acuta primaria, che appare come una sindrome simil-influenzale con febbre, brividi, tosse secca, mialgie, dolore toracico, emicrania e malessere. Talvolta può manifestarsi una polmonite acuta, più raramente pericardite, artrite, artralgie ed eritema nodoso. Altri potenziali sintomi sono broncolitiasi (presenza di materiale calcifico nelle vie aeree) e noduli polmonari che, agli esami radiografici, possono risultare calcificati o non calcificati;
- Cavitaria cronica, che colpisce gli individui di età avanzata che presentano dei danni ai tessuti polmonari, e normalmente è una complicazione della malattia acuta. Questa tipologia di istoplasmosi è distinta dalla presenza di infiltrati polmonari che evolvono in fibrosi portando alla genesi di lesioni cavitarie (in genere apicali) che ricordano quelle tipiche della tubercolosi. I sintomi caratteristici sono febbre, perdita di peso, peggioramento della tosse e dispnea, che progrediscono in disfunzione respiratoria invalidante;
- Progressiva disseminata, che è contraddistinta dall’interessamento del sistema reticolo-endoteliale con conseguente epatomegalia, splenomegalia, linfadenopatia, invasione del midollo osseo, ulcere della mucosa orale o del tratto gastroenterico, e lesioni cutanee papulonodulari, eritematose o pustolose (Fig. 7). Se giunge al sistema nervoso centrale, si ha la comparsa di meningiti e lesioni focali cerebrali, mentre se si estende ai surreni (evento sporadico) può provocare il morbo di Addison (patologia in cui si riduce la secrezione degli ormoni glucocorticoidi e mineralcorticoidi). Questa forma di istoplasmosi raffigura un’infezione opportunistica della sindrome di immunodeficienza acquisita (AIDS).

L’insorgenza dell’istoplasmosi dannosa è collegata a determinati fattori di rischio, tra cui esposizione massiva e protratta, età maggiore di 55 anni, fanciullezza e abbassamento delle difese immunitarie (dovuto all’assunzione di immunosoppressori e/o di corticosteroidi, all’AIDS).
Poiché nella parte sull’epidemiologia avevamo accennato a casi di istoplasmosi su animali, è interessante discutere un episodio di istoplasmosi disseminata in un gatto in Brasile.
Una gatta adulta di età sconosciuta, proveniente da una proprietà rurale, aveva il muso deturpato da lesioni ulcerative che peggiorarono a tal punto che il felino venne portato in una clinica veterinaria. La visita rivelò che l’animale aveva lesioni edematose ed emorragiche che coinvolgevano le regioni nasale e sotto e sopraorbitale destra (Fig. 8), pesava 2,5 kg, manifestava apatia, diarrea lieve, secrezione nasale mucopurulenta, starnuti, disidratazione moderata, ingrossamento dei linfonodi sottomandibolari e scricchiolii polmonari all’auscultazione.

Dall’esame emocromocitometrico la conta degli eritrociti, l’emoglobina e l’ematocrito risultarono poco al di sotto dei valori fisiologici (globuli rossi 4×106/μl, emoglobina 6,3 g/%, ematocrito 20%. Range di riferimento: 5–10×106/μl, 8–15 g/%, 24-25%), mentre il numero dei leucociti, i valori della creatinina e dell’alanina amminotransferasi erano nella norma.
Le analisi citologiche dei campioni prelevati dalle lesioni mostrarono un’ipercellularità di granulociti neutrofili non alterati, macrofagi attivati nel cui citoplasma erano contenuti dei lieviti di forma rotonda od ovale circondati da un alone (Fig. 9). In aggiunta a ciò, si notarono dei batteri di forma coccoide intracellulari ed extracellulari che indicavano un’infezione secondaria. Questi esiti segnalavano un infiltrato poligranulomatoso che alludeva a un’infezione da Histoplasma spp.

Le indagini citologiche furono seguito da quelle microbiologiche, che raffigurano il gold standard della diagnosi di istoplasmosi; i campioni provenienti dalle lesioni vennero seminati su Sabouraud Dextrose Agar, Sabouraud Dextrose Agar con aggiunta di cloramfenicolo e su Mycosel Agar, e incubati a 25° C. Dopo 15 giorni sui terreni si erano formate delle colonie fungine biancastre e dall’aspetto cotonoso. Al microscopio si evidenziarono ife ialine e settate, con i macroconidi sferici e spinosi.
Uno sguardo ai fattori patogenetici
In questa sezione dell’articolo descriviamo i meccanismi impiegati di H. capsulatum nell’induzione della malattia; abbiamo già detto che le spore del micete, dopo aver percorso le vie respiratorie e raggiunto gli alveoli polmonari, subiscono la conversione in lievito. In questo processo di trasformazione sono implicati specifici geni, tra cui DRK-1 (dimorphism regulating kinase), codificante per un’istidina chinasi, e RYP1 (required for yeast phase growth), codificante per un regolatore trascrizionale.
Negli alveoli il micete entra all’interno dei macrofagi tramite endocitosi mediata da recettori; quelli primari espressi sulla superficie dei macrofagi alveolari sono LFA-1 (CD11a/CD18), CR3 (CD11b/CD18) e CR4 (CD11c/CD18), ognuno dei quali ha una subunità alfa comune e una subunità beta unica. Quando la subunità del CD18 è bloccata, il 50-90% del legame del fungo è ostacolato. La proteina ligando localizzata sulla superficie di Histoplasma, coinvolta nell’internalizzazione, è una proteina da shock termico (heat shock protein, Hsp). Le Hsp hanno la funzione di guidare il ripiegamento delle proteine e vengono up-regolate nei momenti di stress. L’up-regolazione dell’Hsp70 avviene durante il passaggio dalla forma filamentosa a quella di lievito. L’Hsp60, espressa sulla parete del lievito, interagisce con CR3 dei macrofagi.
Questo meccanismo di fagocitosi raffigura un benefico per Histoplasma, in quanto non scatena ulteriori vie di segnalazione fungicide, e ciò contribuisce ad aumentare l’abilità del micete a persistere all’interno di una cellula.
Oltre ai recettori sopra citati, i macrofagi possiedono ulteriori molecole di membrana che consentono di identificare i componenti patogeni fungini, e una di queste è la Dectina-1, che riconosce il beta-glucano, uno zucchero che costituisce una grossa porzione della parete di H. capsulatum. Per evadere da tale riconoscimento, il microorganismo cambia la composizione della parete attraverso la produzione degli alfa-glucani, che nascondono i beta-glucani. È stato dimostrato che la riduzione o la perdita degli alfa-glucani comporta una diminuzione notevole della virulenza. Nella sintesi di questi polisaccaridi sono implicati due geni, ossia Ags1, che codifica per l’enzima alfa-(1,3)-glucano sintasi, e Amy1, che codifica per l’enzima alfa-(1,4)-amilasi.
Bisogna sottolineare che l’ingestione dei microorganismi da parte dei macrofagi attiva un’esplosione ossidativa che porta alla sintesi di intermedi reattivi dell’ossigeno (ROS) e dell’azoto (NOS). H. capsulatum possiede dei sistemi che gli consentono di difendersi dal perossido di idrogeno (che fa parte dei ROS), ovvero le tre catalasi CatA, CatB e CatP; la prima viene prodotta dalla forma miceliale, mentre le altre due dal lievito. Tuttavia, mentre CatB esercita il suo ruolo nell’ambiente extracellulare, CatP agisce a livello intracellulare.
A proposito della difesa verso i NOS (come l’ossido nitrico), H. capsulatum esprime 153 geni nel corso dell’infezione, la cui funzione però rimane ignota. Tuttavia, uno di questi, NOR1, esibisce un’alta omologia di sequenza con le reduttasi dell’ossido nitrico presenti in altri funghi e batteri patogeni. Tali enzimi facilitano la conversione dell’ossido nitrico in ossido nitroso, che è meno tossico per le cellule.
Un altro processo che viene messo in atto a seguito della fagocitosi è l’acidificazione del fagosoma, grazie a una pompa protonica, la fusione del fagosoma con i lisosomi e la successiva formazione del fagolisosoma. I lisosomi provvedono ad annientare il patogeno mediante il rilascio di enzimi che agiscono a pH acido. H. capsulatum possiede un gene codificante per un omologo dell’enzima idrossi-metil-glutaril coenzima A (HMG CoA) liasi (Hcl1), fondamentale per la crescita all’interno dei macrofagi e per la conseguente lisi, in particolare in ambienti poveri di glucosio e ricchi di leucina. In altri organismi tale enzima raffigura l’ultima fase del catabolismo dell’amminoacido leucina, e la disfunzione di esso provoca un accumulo di intermedi acidi a causa dell’incapacità di catabolizzare la leucina. L’HMG CoA liasi di H. capsulatum permette di mantenere il pH del fagolisosoma; ceppi mutanti del gene Hcl1 si mantengono all’interno dei macrofagi ma la loro crescita è assai ridotta, a causa della potenziale attivazione degli enzimi lisosomiali. In studi sui modelli murini si è constatato che tale mutazione non mostra una differenza nella virulenza tra ceppi mutati e ceppi selvatici, e ciò suggerirebbe l’esistenza di altre vie di segnalazione che devono essere alterate per inibire la patogenicità del fungo.
È chiaro che affinché H. capsulatum possa compiere i vari processi elencati ha bisogno di nutrienti che influenzano la crescita e la sopravvivenza, come il ferro e le vitamine. Normalmente all’interno del fagosoma (in cui si trova il micete dopo essere stato internalizzato) i nutrienti scarseggiano, quindi il patogeno ricorre a diverse strategie per acquisire le sostanze nutritive, oppure le sintetizza lui stesso. Partendo dal ferro, ricordiamo che durante l’infiammazione, i neutrofili sottraggono il ferro legato alla transferrina per cederlo alla ferritina, di cui uno dei serbatoi sono i macrofagi. Il rilascio intracellulare di questo metallo raffigura una potenziale sorgente per Histoplasma, ma in caso di scarsità, il lievito secerne gli idrossammati, composti chimici che funzionano da siderofori (molecole che solubilizzano il ferro e lo trasportano nelle cellule) e chelanti del ferro.
Per quanto concerne le vitamine, H. capsulatum è capace di sintetizzare le proprie vitamine essenziali mentre si trova nei macrofagi. In un lavoro del 2014, pubblicato su Infection and Immunity, tre ricercatori indagarono l’impatto della sintesi di riboflavina (B6), acido pantotenico (B5) e biotina sulla crescita e proliferazione del fungo. Essi indussero delle mutazioni inattivanti sui geni implicati nelle vie biosintetiche delle tre vitamine (Rib2, Pan6 e Bio2), e scoprirono che in seguito alla distruzione di Rib2 il microorganismo rimane nei tessuti polmonari ma non si replica. L’inattivazione di Pan6 comporta un abbassamento della virulenza, effetto che non si verifica con l’annullamento di Bio2.
Metodi di identificazione
Dal momento che i sintomi dell’istoplasmosi non sono specifici, è fondamentale essere cauti quando si esegue la diagnosi, i cui approcci sono prevalentemente gli esami microscopico, istopatologico, colturale, sierologico e radiografico.
A seconda della sintomatologie, i campioni da prelevare possono essere di vari tipi: bronco-lavaggio alveolare (BAL), espettorato, biopsia polmonare, agoaspirato del midollo osseo, biopsie di organi (linfonodi, fegato, cute, tratto digerente), sangue periferico e liquidi cerebrospinale (CSF).
Per l’analisi microscopica di strisci di campioni liquidi (sangue, midollo osseo, CSF, BAL), o di tessuti su cui si effettua l’apposizione sul vetrino, la colorazione indicata è il May-Grünwald Giemsa (Fig. 9). Per alcuni campioni, come la pelle, il pus o l’essudato, si può fare il trattamento con idrossido di potassio al 10% per poi applicare un vetrino copri-oggetto e osservare il campione al microscopio senza colorazione. Per il sangue periferico, il liquido cefalorachidiano o il fluido bronco-alveolare (dove la cellularità è bassa) può essere necessaria la citocentrifugazione, che concentra il campione in una zona ristretta del vetrino.
Su campioni di biopsie, che si usano per ricercare il fungo nei tessuti (istopatologia), la colorazioni di base è Ematossilina-Eosina, ma è possibile anche applicare colorazioni istochimiche come il metodo di Grocott-Gomori (GMS) (Fig. 6B), la reazione PAS (Fig. 6A) o il Giemsa. Di solito H. capsulatum è collocato all’interno di granulomi e nella maggioranza dei casi è fagocitato da macrofagi, istiociti o cellule giganti, anche se a volte può trovarsi nell’ambiente extracellulare.
Passando all’esame colturale (il gold standard), i principali terreni da utilizzare sono il Sabouraud Dextrose Agar (SDA) con aggiunta di cloramfenicolo (che rende il terreno selettivo per le muffe), il Brain Heart Infusion (BHI) e il Potato Dextrose Agar (PDA). Le piastre vanno poi incubate a 25-30° C per 6-8 settimane. Per confermare che il fungo cresciuto sia effettivamente H. capsulatum, occorrono test integrativi come la valutazione al microscopio dopo colorazione con blu di lattofenolo, che permette di determinare la morfologia del micete con i caratteri identificativi (ife settate e ialine, macroconidi sferici, ovali, grandi e spinosi, microconidi tondi o piriformi, dalla parete liscia) (Fig. 1).
Gli esami sierologici sono l’immunodiffusione, il test di fissazione del complemento e il saggio immnoenzimatico (ELISA), che consistono nel ricercare anticorpi contro gli antigeni del fungo, e confermano un contatto precedente con il patogeno. In queste analisi si utilizza una mistura antigenica estratta da H. capsulatum chiamata istoplasmina. È possibile usare anche la proteina C (un galattomannano), che però è meno specifica ed è responsabile di reazioni crociate con altri funghi.
Per quanto concerne l’esame radiografico polmonare, esso può rivelare diversi quadri a seconda del tipo di infezione:
- Nella forma acuta i polmoni hanno un aspetto normale o nodulare diffuso;
- Nella forma cronica si avvistano lesioni cavitarie;
- Nella forma disseminata si distingue adenopatia ilare con infiltrati nodulari sparsi (50% dei casi).
Ulteriori metodiche analitiche sono quelle molecolari, tra cui la reazione a catena della DNA polimerasi (PCR). Riprendendo l’episodio di istoplasmosi disseminata sul gatto (discusso nella sezione dedicata alla patogenesi), i ricercatori avevano preso delle colonie fungine, le avevano sottoposte ai trattamenti per estrarre il DNA, eseguito l’amplificazione con i due oligonucleotidi OAS1057 (5′-ACC CTT GCA GCT TAC AAC CT-3′) e OAS1058 (5′-TCC GTC CAT CGC TTA ATA CC-3′). Infine avevano effettuato il sequenziamento e l’analisi bioinformatica con BLAST allineando la sequenza sul database GenBank.
Un’altra tecnica molecolare è l’amplificazione isotermica mediata da loop (LAMP), che è altamente efficiente, sensibile e specifica. Questo metodo utilizza quattro oligonucleotidi che riconoscono sei diverse regioni nella sequenza bersaglio. Come vediamo nella figura 10, i due oligonucleotidi interni FIP e BIP hanno delle sequenze legate all’estremità 5’, che sono complementari a una sequenza interna del filamento amplificato e formano un’ansa (loop) ad ogni estremità del filamento di DNA. Gli oligonucleitidi esterni F3 e B3 si appaiano a monte di FIP e BIP, e agiscono da siti di legame per la polimerasi. Rispetto alla PCR, la LAMP si esegue a temperatura costante e non necessita di un termociclatore.

Terapia
La scelta del trattamento per l’istoplasmosi varia a seconda del tipo di patologia:
- Per l’istoplasmosi acuta primaria la terapia con farmaci antimicotici non è necessaria, eccetto nelle situazioni in cui non si nota un miglioramento spontaneo nell’arco di un mese. In questo caso si ricorre all’Itraconazolo 200 mg per via orale tre volte al giorno per tre giorni, per poi passare a una volta al giorno per 6-12 settimane;
- Per l’istoplasmosi cavitaria cronica si impiega l’Itraconazolo 200 mg, somministrato oralmente tre volte al giorno per tre giorni, dopo una o due volte al giorno per 12-24 mesi. Se un paziente è seriamente malato e non mostra alcuna risposta all’Itraconazolo (oppure non lo tollera), si adoperano altri farmaci triazoli o l’Amfotericina B;
- Per l’istoplasmosi disseminata grave il trattamento consiste nella somministrazione di Amfotericina B liposiamle 3 mg/kg una volta al giorno, oppure di Amfotericina B 0,5-1 mg/kg una volta al giorno per due settimane, o fino a quando le condizioni del paziente rimangono inalterate. Successivamente è possibile sostituire il farmaco precedente con Itraconazolo 200 mg, preso per via orale tre volte al giorno per tre giorni, in seguito due volte al giorno per 12 mesi.
In caso di persone affette da AIDS, bisogna somministrare l’Itraconazolo senza la fissazione di un periodo preciso di fine trattamento, o fino a quando il numero dei linfociti T CD4 supera il valore di 150/mcL. Tale procedura serve per evitare possibili ricadute.
L’Itraconazolo inibisce l’enzima 14-alfa-demetilasi, fondamentale per la sintesi di ergosterolo, uno steroide che raffigura un componente principale della membrana cellulare dei miceti, mentre l’Amfotericina B si infiltra nella membrana dei funghi alterandone la permeabilità. Il trattamento con Itraconazolo deve essere monitorato mediante la determinazione dei livelli nel sangue e nelle urine, o tramite il dosaggio degli antigeni del microorganismo.
Fonti
- Nida Ashraf, Ryan C. Kubat, Victoria Poplin, Antoine A. Adenis, David W. Denning, Laura Wright, Orion McCotter, Ilan S. Schwartz, Brendan R. Jackson, Tom Chiller, Nathan C. Bahr. 2020. “Re-drawing the Maps for Endemic Mycoses”, Mycopathologia
- Jamie Mittal , Maria G. Ponce, Inessa Gendlina, Joshua D. Nosanchuk. 2019. “Histoplasma Capsulatum: Mechanisms for Pathogenesis”, Curr Top Microbiol Immunol
- Takao Kasuga, Thomas J White, Gina Koenig, Juan McEwen, Angela Restrepo, Elizabetha Castañeda, Carlos Da Silva Lacaz, Elisabeth M Heins-Vaccari, Roseli S De Freitas, Rosely M Zancopé-Oliveira, Zhenyu Qin, Ricardo Negroni, Deidre A Carter, Yuzuru Mikami, Miki Tamura, María Lucía Taylor, Georgina F Miller, Natteewan Poonwan, John W Taylor. 2003. “Phylogeography of the fungal pathogen Histoplasma capsulatum”, Molecular Ecology
- Kaitlin Benedict, George R. Thompson, Stan Deresinski, and Tom Chiller. 2015. “Mycotic Infections Acquired outside Areas of Known Endemicity, United States”, Emerg Infect Dis.
- Kathy A Burek-Huntington, Verena Gill, Daniel S Bradway. 2014. “Locally acquired disseminated histoplasmosis in a northern sea otter (Enhydra lutris kenyoni) in Alaska, USA”, Journal of Wildlife Diseases
- Kwon-Chung K. June and Bennett Joan E. 1992. “Medical mycology”, Philadelphia: Lea & Febiger
- Liliane Lima da Silva Lomonaco, Stefanie Bressan Waller, Marlete Brum Cleff, Angelita dos Reis Gomes, Barbara Wilka Leal Silva, Rosane de Oliveira Cruz, Talles Monte de Almeida, Amanda Leal de Vasconcellos, Wesley Lyeverton Correia Ribeiro, Renata Osorio de Faria, Mario Carlos Araújo Meireles, Adriana de Queiroz Pinheiro, Paula Priscila Correia Costa. 2020. “Disseminated histoplasmosis in a cat rescued in Fortaleza, Brazil, and successfully treated with itraconazole – First case report identifed molecularly”, Medical Mycology Case Reports
- Fabricio Sevilla-Acosta, Elisandro Jiménez-Cruz, Hazel Álvarez-Cabalceta, Rolando Ulloa-Gutierrez. 2020. “Culture-Proven Disseminated and Meningeal Histoplasmosis Presenting as Septic Shock and Autoimmune Hemolytic Anemia in an Infant”, Cureus
- Emilie V. Hill, Dominick Cavuoti, Hung S. Luu, Erin McElvania TeKippe. 2018. “The Brief Case: Disseminated Histoplasma capsulatum in a Patient with Newly Diagnosed HIV Infection/AIDS”, Journal of Clinical Microbiology
- Chester W. Emmons, Chapman H. Binford, John P. Utz e K. J. Kwon-Chung. 1977. “Medical Micology”, Lea & Febiger
- Andrew L Garfoot, Olga Zemska and Chad A Rappleye. 2014. “Histoplasma capsulatum depends on de novo vitamin biosynthesis for intraphagosomal proliferation”, Infection and Immunity
- Dervla T Isaac, Alison Coady, Nancy Van Prooyen and Anita Sil. 2013. “The 3-hydroxy-methylglutaryl coenzyme A lyase HCL1 is required for macrophage colonization by human fungal pathogen Histoplasma capsulatum”, Infection and Immunity